
Kvantnummer vad är de för och vad är de?

De nkvantnummer används för att beskriva kvanttillståndet för elektronerna i atomen och härstammar från lösningen av Schrödinger-ekvationen för det enklaste av allt: väte.
Schrödinger-ekvationen är en differentiell ekvation, vars lösningar är vågfunktioner och betecknas med den grekiska bokstaven ψ. Oändliga lösningar kan föreslås, och deras kvadrat är lika med sannolikheten att hitta elektronen i ett litet område av rymden, kallat orbital.
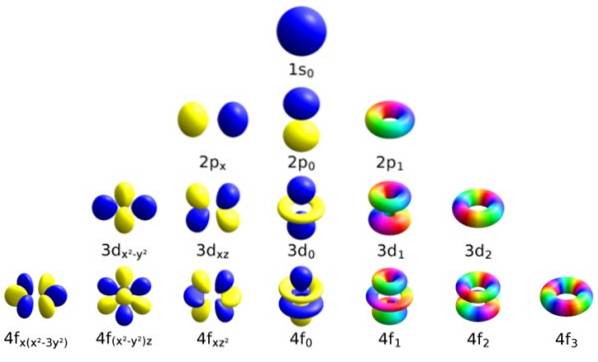
Varje omlopp har bestämda egenskaper som skiljer det från de andra, såsom energi, vinkelmoment och snurr, en helt kvantegenskap hos elektronen och som bland annat är ansvarig för magnetiska effekter..
Sättet att identifiera varje omlopp är att särskilja det med en uppsättning siffror som beskriver det, och dessa är exakt kvantnummer:
-n: är huvudkvantantalet.
-ℓ: det azimutala kvantantalet.
-mℓ, är det magnetiska numret.
-ms, centrifugeringsnumret.
Artikelindex
- 1 Vad är kvantnummer för?
- 1.1 Wave-funktioner
- 2 Vad är kvantnummer?
- 2.1 Huvudkvantnummer
- 2.2 Kvantnummer för azimutalt eller vinkelmoment
- 2.3 Magnetiskt kvantantal mℓ
- 2.4 Snurrkvantantal ms
- 3 Referenser
Vad är kvantnummer för?
Kvantnummer används för att beskriva tillståndet för elektronerna inuti atomen. Atommodellen där elektronen kretsar kring kärnan är felaktig, eftersom den inte överensstämmer med atomstabilitet eller med ett stort antal observerade fysiska fenomen.
Det var därför danska Niels Bohr (1885-1962) lade fram ett djärvt förslag 1913: elektronen kan bara hittas i vissa stabila banor, vars storlek beror på ett heltal som kallas n.
Senare, 1925, föreslog den också österrikiska fysikern Erwin Schrödinger (1887-1961) en differentialekvation i partiella derivat, vars lösningar beskriver väteatomen. De är de vågfunktioner ψ som nämndes i början.
Denna differentiella ekvation inkluderar de tre rumsliga koordinaterna plus tid, men när detta inte ingår är lösningen av Schrödinger-ekvationen analog med en stående våg (en våg som sprider sig mellan vissa gränser).
Wave-funktioner
Den tidsoberoende Schrödinger-ekvationen löses i sfäriska koordinater och lösningen skrivs som en produkt av tre funktioner, en för varje rumslig variabel. I detta koordinatsystem, istället för att använda koordinaterna för de kartesiska axlarna x, Y Y z koordinaterna används r, θ Y φ. På det här sättet:
ψ (r, θ, φ) = R (r) ⋅f (θ) ⋅g (φ)
Vågfunktionen är immateriell, men kvantmekaniken säger oss att den kvadrerade amplituden:
| ψ (r, θ, φ) |två
Det vill säga modulens eller absoluta värde för vågfunktionen, kvadrat, är ett reellt tal som representerar sannolikheten för att hitta elektronen, i ett visst område runt den punkt vars koordinater är r, θ Y φ.
Och detta faktum är något mer konkret och konkret.
För att hitta vågfunktionen måste du lösa tre vanliga differentialekvationer, en för varje variabel r, θ Y φ.
Lösningarna i varje ekvation, som kommer att vara funktionerna R (r), f (θ) och g (φ), innehåller de tre första kvantnummer som nämns.
Vad är kvantnummer?
Vi beskriver kortfattat naturen för varje kvantnummer nedan. De tre första, som tidigare nämnts, härrör från lösningarna i Schrödinger-ekvationen.
Det fjärde numret tillkom av Paul Dirac (1902 - 1984) 1928.
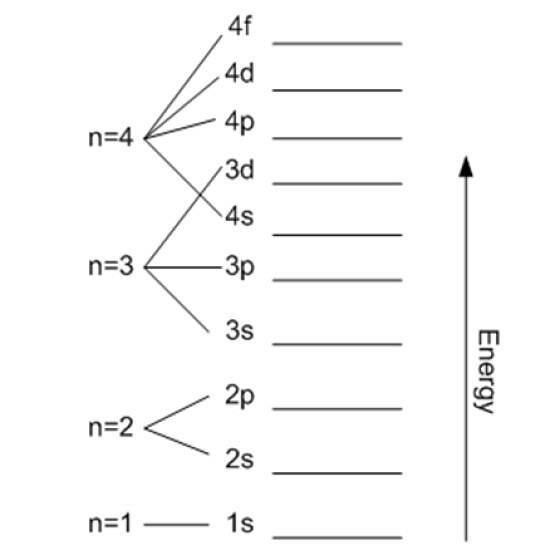
Huvudkvantnummer
Det betecknas med n och anger storleken på den tillåtna banan, liksom elektronens energi. Ju högre värde dess desto längre är elektronen från kärnan och dess energi kommer också att vara högre, men i gengäld minskar den dess stabilitet.
Detta tal härrör från funktionen R (r), vilket är sannolikheten att hitta elektronen på ett visst avstånd r av kärnan, som bestäms av:
-Plancks konstant: h = 6,626 × 10 -3. 4 J.s
-Elektronmassa moch = 9,1 × 10-31 kg
-Elektronladdning: e = 1,6 × 10-19 C.
-Elektrostatisk konstant: k = 9 × 10 9 N.mtvå/ Ctvå
När n = 1 motsvarar det Bohr-radien som är ungefär 5,3 × 10−11 m.
Förutom det första lagret delas de andra upp i underlag eller undernivåer. Varje skal har en energi i elektronvolt som ges av:

- K (n = 1)
- L (n = 2)
- M (n = 3)
- N (n = 4)
- O (n = 5)
- P (n = 6)
- Q (n = 7).
I teorin finns det ingen övre gräns för n, men i praktiken observeras att den bara når n = 8. Den lägsta möjliga energin motsvarar n = 1 och är den för grundläggande stat.
Azimutalt eller vinkelmomentkvanttal
Betecknas med den kursiva bokstaven ℓ, detta nummer bestämmer formen på orbitalerna genom att kvantifiera storleken på elektronens banvinkelmoment.
Det kan ta positiva värden och heltal mellan 0 och n-1, till exempel:
-När n = 1, då ℓ = 0 och det finns bara ett undernivå.
-Om n = 2 kan ℓ vara lika med 0 eller 1, så vi har två undernivåer.
-Och om n = 3, antar the värdena 0, 1 och 2 och det finns 3 undernivåer.
Det kan fortsättas på detta sätt på obestämd tid, men som sagt tidigare går n i praktiken upp till 8. Delnivåerna betecknas med bokstäverna: s, sid, d, F Y g och de ökar i energi.

Magnetiskt kvantantal mℓ
Detta nummer bestämmer banans orientering i rymden och dess värde beror på of.
För en given ℓ finns (2ℓ + 1) heltal värden på m ℓ, som motsvarar respektive orbitaler. Dessa är:
-ℓ, (- ℓ + 1),… 0,… (+ ℓ -1), + ℓ.
Exempel
Om n = 2 vet vi att ℓ = 0 och ℓ = 1, då m ℓ tar följande värden:
-För ℓ = 0: m ℓ = 0.
-För ℓ = 1: m ℓ = -1, m ℓ = 0, m ℓ = +1
Orbitalet n = 2 har två undernivåer, den första med n = 2, ℓ = 0 och m ℓ = 0. Sedan har vi det andra delnivån: n = 2, ℓ = 1, med 3 orbitaler:
- n = 2, ℓ = 1, m ℓ = -1
- n = 2, ℓ = 1, m ℓ = 0
- n = 2, ℓ = 1, m ℓ = +1
De tre orbitalerna har samma energi men olika rumsliga orientering.
Snurrkvantantal ms
När man löser Schrödinger-ekvationen i tre dimensioner, kommer de redan beskrivna siffrorna fram. Men i väte observeras en ännu finare struktur som dessa siffror inte räcker för att förklara.
Av denna anledning föreslog 1921 en annan fysiker, Wolfgang Pauli, att det fanns ett fjärde nummer: snurrnummer ms, som tar värden på + ½ eller -½.
Detta nummer beskriver en mycket viktig egenskap hos elektronen, som är snurra, ord som kommer från engelska snurra (för att sätta på sig själv). Och snurringen är i sin tur relaterad till atomens magnetiska egenskaper.
Ett sätt att förstå snurr är att föreställa sig att elektronen beter sig som en liten magnetisk dipol (en magnet med nord- och sydpoler), tack vare en rotation runt sin egen axel. Rotationen kan vara i samma riktning som medurs eller i motsatt riktning.
Även om Pauli föreslog förekomsten av detta nummer, hade resultaten av ett experiment som utfördes av Otto Stern och Walter Gerlach 1922 redan förväntat det..
Dessa forskare lyckades dela en stråle av silveratomer i två genom att applicera ett icke-enhetligt magnetfält.
Värdet av ms beror inte på n, ℓ och m ℓ. I grafisk form representeras den av en pil: en uppåtpil indikerar en medurs vridning och en nedåtpil indikerar en moturs sväng.
Pauli-uteslutningsprincip
Elektronernas beteende i atomen sammanfattas i Pauli-uteslutningsprincipen, som säger att två elektroner i en atom inte kan existera i samma kvanttillstånd.
Därför måste varje elektron ha en annan uppsättning kvantnummer n, ℓ, m ℓ och Ms.
Betydelsen av kvantnummer och denna princip ligger i förståelsen av elementens egenskaper i det periodiska systemet: elektroner är organiserade i lager enligt n, och sedan i underlag enligt ℓ och resten av siffrorna.
Referenser
- Alonso, M. 1971. Kvant- och statistiska grunder. Interamerikansk utbildningsfond.
- Bauer, W. 2011. Fysik för teknik och vetenskap. Volym 1. Mc Graw Hill.
- Chang, R. 2013. Kemi. 11: e. Utgåva. Mc Graw Hill utbildning.
- Eisberg-Resnick. 1989. Kvantfysik. Limusa - Wiley.
- Giambattista, A. 2010. Fysik. 2: a. Ed McGraw Hill.
- Rex, A. 2011. Grundläggande fysik. Pearson.
- Tippens, P. 2011. Fysik: begrepp och tillämpningar. 7: e upplagan. Mcgraw hill.



Ingen har kommenterat den här artikeln än.