
Vad är det periodiska systemet för? 7 Viktiga användningsområden

De periodiska systemet Det tjänar till att visa relationerna mellan de olika elementen; Det kan också användas för att förutsäga egenskaperna hos nya element som ännu upptäckts eller ännu inte syntetiserats..
Det ger information och data om grupperna, elementen, atommassan, joniseringsenergin, elektronisk konfiguration, atomnummer, elektronegativitet och oxidationstillstånd. Det periodiska systemet ger också en användbar ram för analys av kemiskt beteende. Det används ofta inom kemi och i många andra vetenskaper.
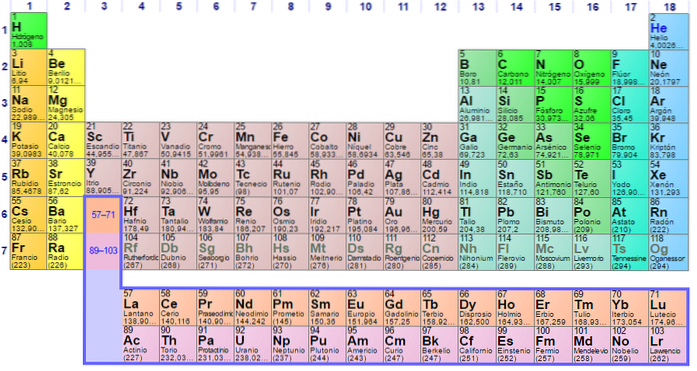
Det byggdes 1869 av den ryska forskaren Dmitri Ivanovich Mendeleev för att visualisera de olika förhållandena mellan de olika kemiska elementen.
Det periodiska systemet ordnas efter dess atomnummer, elektronkonfigurationer och återkommande kemiska egenskaper. Det ordnas också så att artiklar med liknande beteenden finns i samma kolumn.
Tabellen har fyra rektangulära block med liknande kemiska egenskaper. I allmänhet är elementen på vänster sida av en rad metaller och de icke-metallerna till höger.
Element är placerade på det periodiska systemet baserat på deras atomstruktur. Varje rad och varje kolumn har speciella egenskaper.
Alla rader i tabellen läses från vänster till höger och varje rad kallas en period. Varje kolumn i tabellen kallas en grupp. Varje grupp i tabellen har samma antal elektroner.
Det är lätt att hitta antalet elektroner i det yttre skalet på varje element i tabellen. Grupp en har en elektron, grupp två har två och så vidare.
En bra periodisk tabell är ett utmärkt verktyg för problemlösning inom kemi. Periodiska tabeller finns på webben eller de kan skrivas ut.
Användning av det periodiska systemet vad är det för?
Känn symbolen för det kemiska grundämnet
Symboler är stenografi för artikelns namn. I många fall kommer förkortningen från det ursprungliga latinska namnet.
Varje symbol har en eller två bokstäver som förkortning. Vanligtvis är symbolen en förkortning av elementets namn men vissa symboler hänvisar till de gamla namnen på elementen.
Ett exempel på detta fall är silver; dess symbol är Ag, som hänvisar till dess gamla namn som var argentum.
Känn elementets atomnummer
Detta är antalet protoner som en atom av detta element innehåller. Antalet protoner är den avgörande faktorn när det gäller att skilja ett element från ett annat. Variationen i antalet elektroner eller neutroner ändrar inte typen av element.
Ändrade antal elektroner producerar joner, medan förändringar i antalet neutroner producerar isotoper. Det moderna periodiska systemet är ordnat i stigande ordning på atomnummer.
Identifiera vad perioderna och grupperna i det periodiska systemet betyder
De horisontella raderna kallas perioder. Varje period indikerar den högsta energinivån som var och en av elektronerna i det elementet upptar i sitt bastillstånd..
De vertikala kolumnerna kallas grupper. Varje element i en grupp har samma valenselektronnummer och de beter sig vanligtvis på liknande sätt när de är relaterade till andra element..
De sista två raderna, lantaniderna och aktiniderna, tillhör grupp 3B och listas separat..
Känn elementets namn
Många periodiska tabeller innehåller också artikelns fullständiga namn. Detta är användbart när det gäller att känna till ett element eftersom du inte alltid kommer ihåg symbolerna för alla element.
Bli bekant med elementets atommassa i atommasseenheter
Detta tal avser den genomsnittliga tunga massan av isotoperna för ett kemiskt element. Mendeleevs ursprungliga periodiska system var organiserat så att elementen visades i stigande ordning av atommassa eller vikt..
Identifiera typerna av element
Många periodiska tabeller identifierar olika typer av element genom att använda olika färger för olika typer av element.
Dessa typer inkluderar alkalimetaller, basmetaller, övergångsmetaller, icke-metaller, ädelgaser, allogener, alkaliska jordarter, halvmetaller, aktinider och lantanider..
Visa olika trender (periodicitet)
Det periodiska systemet är organiserat för att visa olika typer av trend (periodicitet). Mellan dem:
- Atomradien, som är halva avståndet mellan centra för två atomer som knappt rör varandra:
- Det ökar när du flyttar från toppen till botten av det periodiska systemet.
- Den sjunker när den rör sig från vänster till höger genom det periodiska systemet.
- Joniseringsenergi, vilket är den energi som krävs för att ta bort en elektron från atomen.
- Den sjunker när den rör sig upp och ner i det periodiska systemet.
- Ökar när du flyttar från vänster till höger på det periodiska systemet.
- Elektronegativitet, som mäter förmågan att bilda en kemisk bindning.
- Den sjunker när den rör sig upp och ner.
- Ökar när du flyttar från vänster till höger.
- Elektronaffinitet, som hänvisar till elementets förmåga att acceptera en elektron.
Elektronaffinitet kan förutsägas baserat på grupperna av elementen. Ädelgaser, såsom argon och neon, har nästan noll elektronaffinitet och tenderar inte att acceptera elektroner..
Halogener, som klor och jod, har höga elektronaffiniteter. De flesta andra grupper av element har elektronaffiniteter som är lägre än för allogener, men mycket högre än för ädelgaser..
Referenser
- Vad är syftet med det periodiska systemet? Återställd från reference.com
- Hur man använder ett periodiskt system (2017) Återställt från thoughtco.com
- Hur är elementen i det periodiska systemet organiserade? Återställd från reference.com
- Periodiska systemet. Återställd från wikipeda.org
- Varför är det periodiska systemet användbart. Återställd från reference.com



Ingen har kommenterat den här artikeln än.