
Peroxidegenskaper, nomenklatur, användningsområden, exempel
De peroxider är alla de kemiska föreningarna som innehåller peroxogruppen, O-O, antingen kovalent kopplad till kolatomer eller andra funktionella grupper, eller i jonisk form såsom peroxidanjonen,tvåtvå-. Ovanstående visas grafiskt i bilden nedan. I den är gruppen O-O markerad med en blå färg.
Det kan finnas organiska peroxider såsom diakylperoxider (R1-O-O-Rtvåhydroperoxider (R-O-O-H), persyror (RCO-O-O-H) och perestrar (R ^)1CO-O-O-Rtvå). Vi har också oorganiska peroxider, såsom metalliska peroxider (Mn+ELLERtvåtvå-väteperoxid (H-O-O-H). Den senare är den mest kända av alla och får namnet väteperoxid.
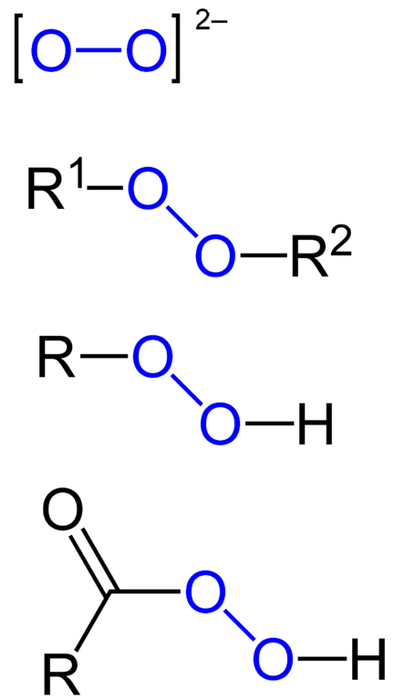
Gemensamt för alla peroxider är att de är mycket reaktiva, oxiderande och i vissa fall explosiva ämnen. Om de inte syntetiseras anses de vara oönskade och farliga föroreningar för många industriella processer och för laboratoriesyntes..
Peroxider är i allmänhet utmärkta oxiderande, blekande, bakteriedödande medel och aktivatorer av polymerisationer via bildandet av fria radikaler. Det är därför de vanligtvis är mycket användbara reagens eller tillsatser inom polymerindustrin, liksom inom livsmedelsindustrin för att påskynda oxidationen och eliminera bakterier..
Artikelindex
- 1 Egenskaper hos peroxider
- 1.1 Struktur
- 1.2 Reaktivitet
- 1.3 Oxiderande verkan
- 1.4 Känslighet
- 2 Nomenklatur
- 3 Utbildning
- 4 Användningar av peroxider
- 4.1 Polymerisationsinitiatorer
- 4.2 Blekmedel och desinfektionsmedel
- 4.3 Oxidationsmedel
- 4.4 Syrekällor
- 5 Exempel på peroxider
- 6 Referenser
Egenskaper hos peroxider
Strukturera
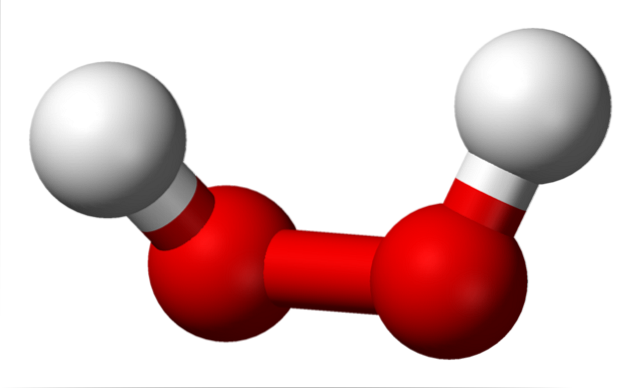
Peroxidernas strukturer är centrerade kring O-O-gruppen. Varje syreatom har en sp-hybridisering3, så -O-O- länkarna vilar inte på samma plan. Till exempel, för väteperoxid, H-O-O-H, är vinkeln som bildas mellan de två Hs 115,5 °, vilket visar att de fyra atomerna inte är i ett plan..
Förvrängningarna av denna och andra vinklar beror på identiteten hos de andra molekylära fragmenten som är kopplade till O-O-gruppen..
Å andra sidan kan organiska och oorganiska peroxider (med undantag av metalliska) kännas igen med blotta ögat om O-O-gruppen är detaljerad i sin struktur, som två glas med en "mun". På detta sätt identifieras varje peroxid omedelbart med en enda blick av dess struktur..
Reaktivitet
O-O-bindningen är relativt svag jämfört med andra bindningar, såsom C-H eller C-O. Det är därför det tenderar att bryta ner eller fragmentera för att producera mycket reaktiva syrerade radikaler..
Det är på grund av dessa radikaler som peroxider klassificeras som reaktiva och farliga ämnen, eftersom de kan skada vävnader och organiskt material i allmänhet..
Oxiderande verkan
Peroxider är kraftfulla oxidationsmedel som försöker få elektroner från omgivningen för att förvandlas till vatten, syre eller hydroxider. Till exempel är väteperoxid ett starkare oxidationsmedel än kaliumpermanganat i sig..
Denna oxiderande verkan används för att detektera dem genom deras reaktion med järnsulfat och kaliumtiocyanat:
Peroxid + Fetvå+ + SCN- → Fe (SCN)n(3-n)- (n = 1 till 6).
Komplexet bildades mellan Fe3+ och SNA- den är blodröd i färg, så att observera denna färg motsvarar ett positivt test för närvaron av peroxider i provet.
Känslighet
Peroxider är ämnen som är känsliga för höga temperaturer och solljus. Därför bör de förvaras på säkra platser och i ogenomskinliga plastbehållare, så att ljus inte lyser direkt på dem..
Nomenklatur
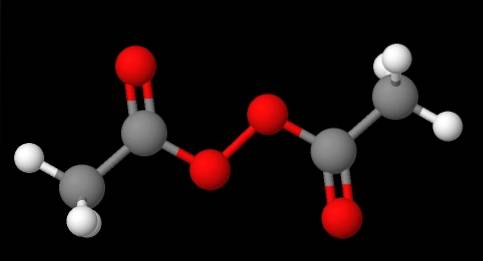
Peroxidernas nomenklatur beror på vilken typ de tillhör. I allmänhet nämns många genom att nämna "peroxid" följt av R-substituenterna i alfabetisk ordning. Exempelvis kan föreningen CH3C (O) OOC (O) CH3 (lägre bild) kallas diacetyl eller acetylperoxid, eftersom den har en acetylgrupp i varje ände.
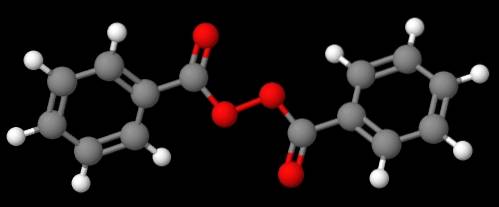
Förening C6H5C (O) OOC (O) C6H5 (lägre bild), å andra sidan, kallas det dibensoyl eller bensoylperoxid, av samma skäl som förklarades i föregående stycke.
Under tiden förening C6H5C (O) OOC (O) CH3 Det kallas acetylbensoylperoxid. Denna gång nämns acetylsubstituenten först genom att börja med bokstaven 'a'. Ett annat exempel är CH3CHtvåOOC6H5, kallas etylfenylperoxid.
På liknande sätt fortsätter vi med hydroperoxiderna. Till exempel CH3OOH kallas metylhydroperoxid.
Träning
Vissa peroxider kan bildas direkt genom att ämnet i fråga exponeras för syre i luften, assisterad eller inte med metalliska katalysatorer. De kan också bildas genom att ämnet utsätts för ozon under vissa förhållanden, genom att utföra ozonolysreaktionen..
En annan syntetisk väg är att reagera väteperoxid med ett alkylsulfat:
RtvåSW4 + HtvåELLERtvå → R-O-O-R + HtvåSW4
För att syntetisera eller bilda dialkylperoxider eller till och med cykliska peroxider.
Under tiden är flera av metoderna för att bilda metallperoxider baserade på att de syrerar sina respektive metalloxider, så att de "syresätter" och går från att vara MO (Mn+ELLERtvå-) kärlektvå (Mn+ELLERtvåtvå-).
Användning av peroxider
Polymerisationsinitiatorer
Peroxider, speciellt organiska peroxider, tillsätts till reaktionsmedia för syntes av oändligheter av plast och material såsom polystyren, silikon, epoxi- och akrylhartser, polyvinylklorid, glasfiber, bland andra.
Detta beror på att de genomgår termisk nedbrytning för att bli syresatta fria radikaler, vilket i sin tur utlöser och katalyserar polymerisationer. Därför är de önskvärda inom polymerindustrin..
Några av de peroxider som används som initiatorer är metyletylketon (MEK) peroxid och acetonperoxid.
Blekmedel och desinfektionsmedel
Peroxider är blekmedel som används för blekning av pappersmassa och mjöl. På samma sätt är de desinfektionsmedel, helt effektiva men aggressiva när det gäller utrotning av bakterier. Det klassiska exemplet motsvarar väteperoxid, som används i utspädda lösningar (3%) för att desinficera sår..
Oxiderande ämnen
Peroxider är också oxidationsmedel, så de hittar många användningsområden i de organiska synteserna av starkt syresatta ämnen..
Syrekällor
Även om det inte är en av dess huvudsakliga användningsområden, kan peroxider också fungera som syrekällor i vissa av dess nedbrytning. Detta är återigen fallet med väteperoxid.
Exempel på peroxider
Slutligen listas några exempel på peroxider, vare sig organiska eller oorganiska, med deras formler och respektive namn:
-HtvåELLERtvå: väteperoxid eller väteperoxid
-NatvåELLERtvå: natriumperoxid
-Stråletvå: bariumperoxid
-C6H5C (CH3)tvåOOH: kumenhydroperoxid
-(NH4)tvåStvåELLER8: Ammoniumpersulfat
- HO3SOOSO3H: peroxisvavelsyra
-(CH3)3COOC (CH3)3: ditert-butylperoxid
Referenser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. (10th utgåva.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2020). Organisk peroxid. Återställd från: en.wikipedia.org
- Elsevier B.V. (2020). Peroxid. ScienceDirect. Återställd från: sciencedirect.com
- Avancerad kemiutveckling. (s.f.). Alkoholer, fenoler och deras derivat:
- Peroxider Regel C-218. Återställd från: acdlabs.com
- Vol'nov I.I., Petrocelli A.W. (1966) Klassificering och nomenklatur för oorganiska peroxidföreningar. I: Petrocelli A.W. (red.) Peroxider, superoxider och ozonider av alkaliska och alkaliska jordmetaller. Springer, Boston, MA.

Ingen har kommenterat den här artikeln än.