
Vattenfysikaliska och kemiska egenskaper

De vattnets fysikaliska och kemiska egenskaper De är alla de manifestationer av vatten som vi kan mäta tack vare interaktioner mellan dess molekyler med sig själva eller sin omgivning. Men vad är vatten? Vatten är en kemisk substans eller molekyl som bildas genom föreningen av en syreatom (O) med två väteatomer (H).
Dessa tre atomer hålls samman genom bildandet av kovalenta bindningar, mycket starka och stabila bindningar. Vattenmolekylen har formeln HtvåEller så kan den skrivas som H-O-H. Det är denna molekyl, dess bindningar och deras interaktioner som är ansvariga för att den är en färglös och smaklös flytande substans..

Vatten är i stor del fördelat över hela jorden, mellan färskt och saltvatten. Vatten är viktigt för att det ska finnas liv på vår planet, eftersom det är en mycket värdefull naturresurs. Det finns mellan 60 och 70% i levande organismer, vilket är en hög andel som gör att de kan utföra otaliga funktioner.
Några av dessa viktiga funktioner inkluderar strukturella, reglerande, såsom att hålla kroppstemperaturen och reglera pH (surhet eller alkalinitet) inom normala gränser. På samma sätt transporterar vatten näringsämnen och avfall i levande varelser.
Det används också i många områden av människans produktiva, tekniska, vetenskapliga och dagliga rutin; från rengöring, matlagning, bland andra användningsområden.
Artikelindex
- 1 Fysiska egenskaper hos vatten
- 1.1 Smak
- 1.2 Utseende
- 1.3 Vattentillstånd
- 1.4 Densitet
- 1.5 Fryspunkt
- 1.6 Kokpunkt
- 1.7 Elektrisk ledningsförmåga
- 1.8 Sammanhållning
- 1.9 Anslutning
- 1.10 Ytspänning
- 1.11 Kapillaritet
- 1.12 Lösningsmedel
- 2 Kemiska egenskaper hos vatten
- 2.1 Kemisk natur
- 2.2 Polaritet
- 2.3 Jonisering
- 2.4 Reaktiv kapacitet
- 2,5 pH
- 2.6 Amfoterism
- 3 Referenser
Fysiska egenskaper hos vatten
De fysiska egenskaperna hos vatten är relaterade till de egenskaper eller storheter som kan mätas eller bestämmas när man överväger materia, såsom dess massa, energi, bland andra..
Bland de fysiska storheterna av vatten är dess färg, lukt, formerna i vilka det kan hittas och alla de som vi kan bestämma utan att producera reaktioner eller ändra dess kemiska sammansättning..
Smak
När vi smakar lite rent vatten, finner vår smak att det är smaklöst eller smaklöst. Det är också luktfritt eller luktfritt. På grund av reningsprocessen kan du ibland uppleva en lätt lukt som beror på klorrester. Det är mineralerna som ger vattnet olika smakkort.
Utseende

Vatten är i allmänhet färglöst och transparent när det ses i en glasbägare. Det verkar dock ha en lätt ljusblå färg när den ackumuleras i stora mängder i stora behållare eller när den observeras på glaciärer, floder eller hav..
Och det är faktiskt att vattnet uppvisar en viss blek blåaktig färg, vars uppfattning är koncentrerad ju större vattenmängd..
Vattentillstånd
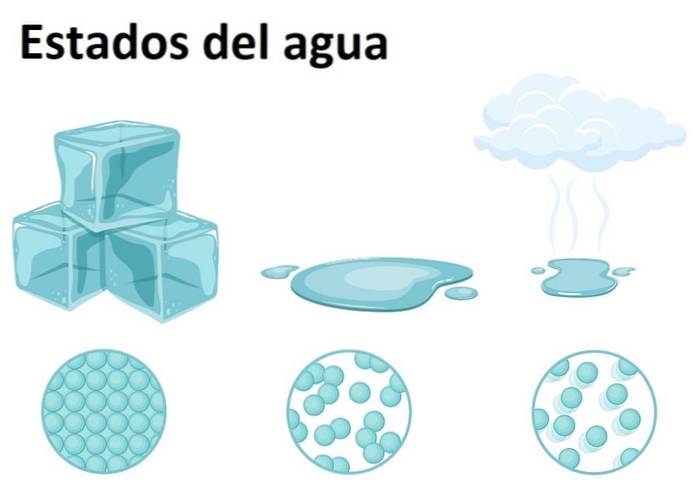
Vatten är mycket rikligt på jorden och kan hittas i något av de tre tillstånden av materia: fast, flytande eller gas. Vatten vid rumstemperatur är ett flytande ämne, vilket motsvarar den vanligaste formen.
Som ett fast ämne kallas vatten is eller snö, beroende på storleken på dess kristaller och processen för deras bildning. Under tiden bildas det gasformiga tillståndet när vatten går från en vätska till ett gasformigt tillstånd och bildar den berömda vattenångan, lätt att känna igen i köket och ovanpå maten..
Densitet
Densiteten för rent vatten är cirka 1 g / cm3. Under tiden är tätheten av havsvatten lite högre på grund av saltet som det innehåller..
Frys punkt
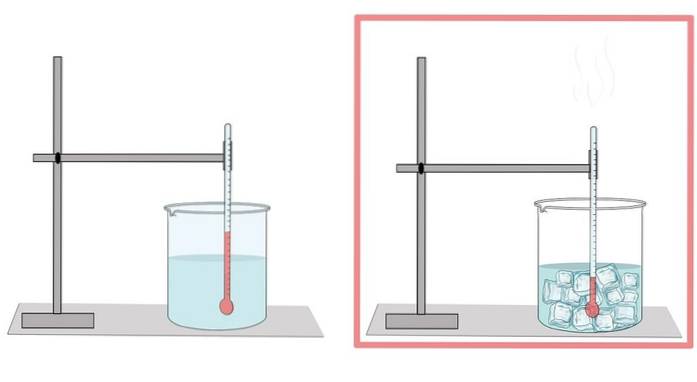
Vatten fryser vid 0 ° C. Vid denna temperatur passerar den från sin flytande fas till den fasta fasen. När vattnet fryser expanderar det. Därför har den i sin fasta form en lägre densitet än i flytande tillstånd, vilket gör det lättare för is att flyta på flytande vatten..
Detta är också anledningen till att när vattnet i en flaska kyls, bör det inte fyllas så mycket, eftersom isen expanderar och slutar bryta flaskan..
Kokpunkt
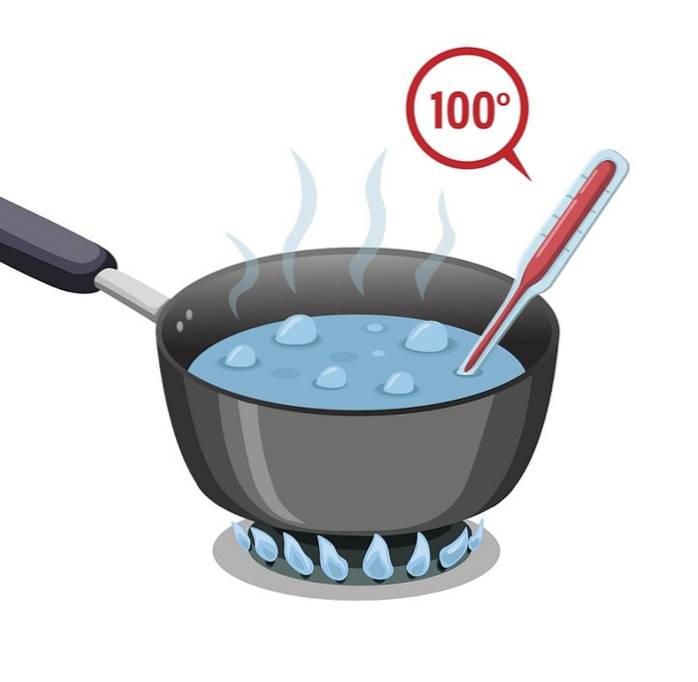
Vatten har en hög kokpunkt som är 100 ° C. Det måste utsättas för mycket värme så att det kan värmas upp och koka eller nå sin kokpunkt.
Vattnet har då en hög specifik värme, eller kallas även värmekapacitet, vilket gör att det tar tid att värma upp; men även vid kylning, det vill säga processen som krävs för att förlora värmen som erhållits är långsam.
Den här egenskapen gör den mycket användbar i kylsystem, i kroppstemperaturregleringssystem, bland annat relaterade.
Elektrisk ledningsförmåga
Vatten är en bra elektriskt ledare. Oavsett hur rent vatten är, kommer det alltid att ha en viss mängd joner, vilket ger det egenskapen att ha en av de högsta dielektriska konstanterna bland icke-metalliska vätskor..
Sammanhållning
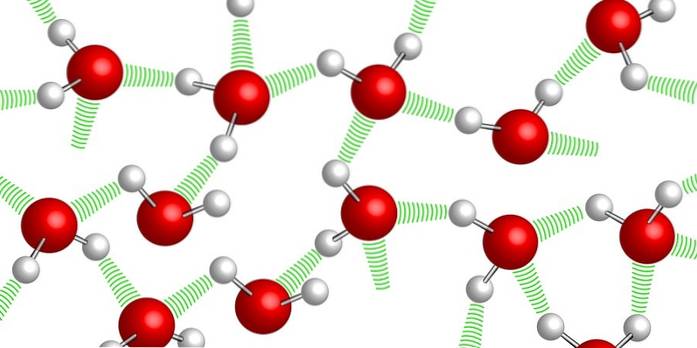
Vattenmolekyler hålls samman tack vare de så kallade vätebindningarna: svaga bindningar som etableras mellan en och en annan vattenmolekyl. På grund av denna höga sammanhållningsgrad är det mycket svårt att komprimera vattnet.
Anslutning

Det är lätt för vatten att fästa, till exempel, på den mycket rena ytan på ett glas och bilda en film som vi kallar fuktighet eller "våt". Dessutom häftar vatten snabbt fast i vår hud, så vi blir våta så snart det regnar eller när vi kommer in i en pool. Annars skulle vi vara torra på några sekunder.
Ytspänning
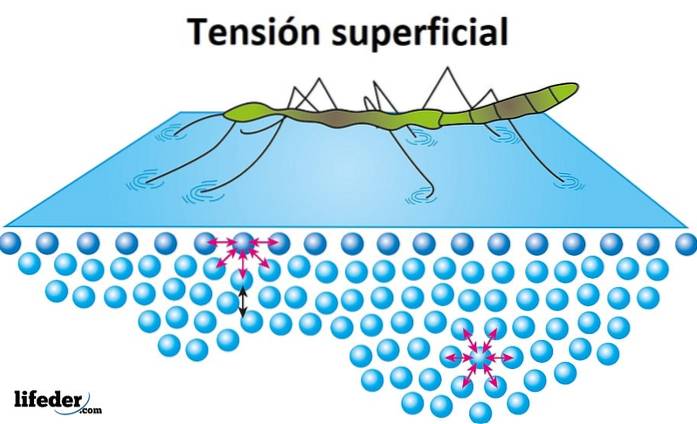
Ytspänning är det motstånd som vätskan erbjuder på dess yta som ska penetreras. Vatten har en hög ytspänning, en produkt av sammanhållningen som finns mellan dess molekyler, vilket gör att den lätt bildar droppar istället för att spridas fritt på en jämn yta..
Ytspänningen är uppenbar när insekter verkar röra sig eller gå på vatten utan att sjunka, och det är anledningen till att vissa löv eller andra ljusföremål kan flyta på vattnet.
Kapillaritet

Den lätthet med vilken vatten rör sig upp eller ner i ett kapillärrör beskriver kapilläregenskapen hos vatten. Denna egenskap beror också på vattenens höga sammanhållnings- och vidhäftningsegenskaper..
Kapillaritet används av växtnaturen för att tillföra vatten till löven på ett träds högsta grenar, såväl som för att underlätta dess absorption av växtrötter..
På samma sätt innebär egenskaperna hos ytspänning och kapillaritet att vatten är en strukturell del av cellerna, att det är en del av blodet och att det går eller rinner lätt genom de olika blodkärlen..
Lösningsmedel

Vatten kan lösa upp många ämnen, vilket är viktigt för levande organismer, eftersom alla kemiska reaktioner i levande saker sker i ett vattenhaltigt medium. I levande organismer tjänar det till att transportera näringsämnen, joner och många andra ämnen.
Det tjänar också till att transportera avfall, såsom urea, som elimineras i urinet. När ett ämne löser sig och blandas väl med vatten sägs det vara hydrofilt eller vattenlösligt. Om det inte blandas eller löses bra sägs ämnet vara hydrofobt eller olösligt i vatten.
Kemiska egenskaper hos vatten
Kemiska egenskaper eller egenskaper är de som uppstår när förändringar inträffar i vattnets kemiska struktur. Det är då viktigt att ta en kort titt på dess molekylära struktur..
Kemisk natur
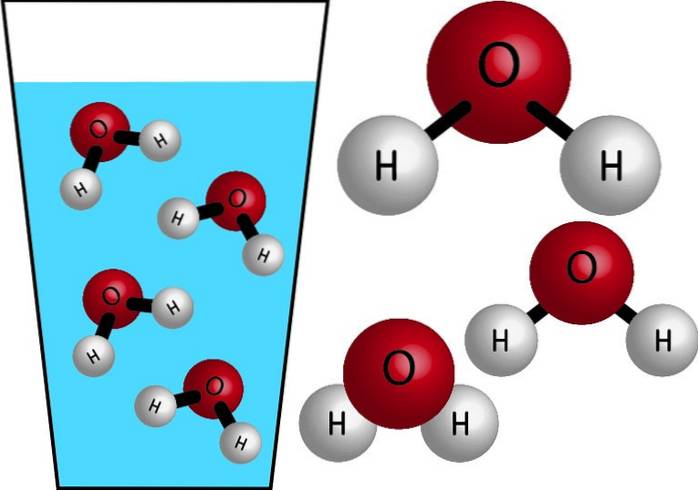
Vatten är en oorganisk molekyl, eftersom den inte innehåller C (kol), och dess kemiska formel är HtvåO. Deras atomer förenas genom att dela elektroner och bilda kovalenta bindningar, starka och mycket stabila bindningar. Dess molära massa är 18 g / mol, det vill säga en mol vatten har en massa på 18 gram.
Polaritet
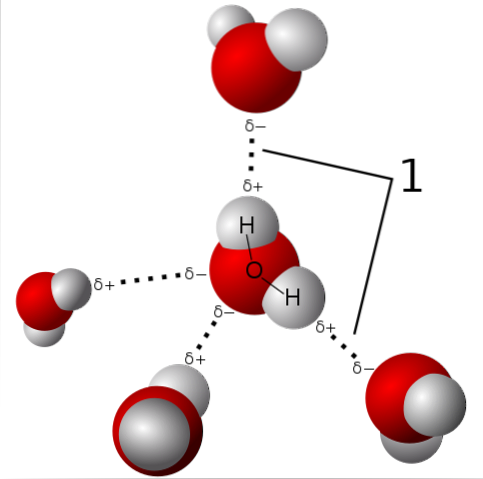
Vattenmolekylen är neutral, men har en viss polaritet, eftersom delningen av dess elektroner inte är så rättvis.
När syre drar de delade elektronerna mot sig själv med mer kraft förblir vattenmolekylen med denna sida där syret är, med en tendens att ha en viss negativ laddning; och därför lämnas den med en positiv partiell laddning mot där väten är (se den övre bilden).
Denna polaritet underlättar föreningen av vattenmolekyler med varandra och föreningen av vatten med andra molekyler som också har laddningsskillnader i sin struktur, vilket främjar de fysiska egenskaper som beskrivs i föregående avsnitt..
Jonisering
Spontant i flytande vatten sker en lätt jonisering eller självdissociation. Det betyder att vissa av dess molekyler omorganiseras genom att ändra sin normala molekylära struktur, vilket genererar nya elektriskt laddade molekyler, såsom hydronjoner (H3ELLER+och hydroxyl (OH-).
Reaktiv kapacitet
Vatten reagerar med många ämnen och bildar en stor mångfald av kemiska föreningar. Genom elektrolys kan vatten sönderdelas och separera syre från dess två väten. Denna process inträffar när en elektrisk ström passerar genom vattnet. Även vatten i sin fasta form kan också ingå i vissa kemiska reaktioner.
pH

Rent vatten har ett neutralt pH (lika med 7), medan havsvatten är något alkaliskt (större än 7). Regnvatten blir något surt (pH mindre än 7) när det blandas med komponenter som finns i atmosfären, såsom koldioxid eller CO.två, till exempel.
Amfoterism
Vatten är amfotert, det vill säga det kan bete sig som en syra eller som en bas beroende på lösningens pH. Denna kemiska egenskap stöder dess roll som pH-regulator..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Castillero M. O. (2020). Psykologi och sinne. De 15 fysikaliska och kemiska egenskaperna hos vatten. Återställd från: psicologiaymente.com
- Wikipedia (2020). Egenskaper hos vatten. Återställd från: en.wikipedia.org
- Sharp K. A. (s.f.). Vatten: struktur och egenskaper. Återställd från: crystal.med.upenn.edu
- BYJU'S. (s.f.). Fysiska och kemiska egenskaper hos vatten. Återställd från: byjus.com
- Skolans energi och miljö. (s.f.). Vatten var en resurs. Återställd från: eniscuola.net



Ingen har kommenterat den här artikeln än.