
Vad är dipoldipolkrafter?
De dipol dipol krafter eller Keesom-krafter är de intermolekylära interaktioner som finns i molekyler med permanenta dipolmoment. Det är en av Van der Waals-krafterna och även om den är långt ifrån den starkaste är den en nyckelfaktor som förklarar de fysiska egenskaperna hos många föreningar..
Uttrycket "dipol" hänför sig uttryckligen till två poler: en negativ och en positiv. Således talar vi om dipolära molekyler när de har definierade regioner med höga och låga elektrontätheter, vilket endast är möjligt om elektronerna "migrerar" företrädesvis till vissa atomer: de mest elektronegativa..
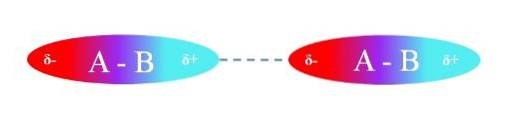
Den övre bilden illustrerar dipol-dipol-interaktioner mellan två A-B-molekyler med permanenta dipolmoment. På samma sätt kan man observera hur molekylerna är orienterade så att interaktionerna är effektiva. Således lockar den positiva regionen δ + den negativa regionen δ-.
Enligt ovan kan det specificeras att dessa typer av interaktioner är riktade (till skillnad från jonladdningsinteraktioner). Molekylerna i sin omgivning orienterar sina poler på ett sådant sätt att, även om de är svaga, men summan av alla dessa interaktioner ger föreningen stor intermolekylär stabilitet..
Detta resulterar i att föreningar (organiska eller oorganiska) som kan bilda dipol-dipolinteraktioner uppvisar höga kokpunkter eller smältpunkter..
Artikelindex
- 1 Dipolmoment
- 1.1 Symmetri
- 1.2 Asymmetri i icke-linjära molekyler
- 2 Orienteringar av dipolerna
- 3 Interaktioner med vätebindningar
- 4 Referenser
Dipole ögonblick
Dipolmomentet µ för en molekyl är en vektormängd. Med andra ord: det beror på riktningarna där det finns en polaritetsgradient. Hur och varför kommer den här lutningen? Svaret ligger i bindningarna och i elementens atomer..
I den övre bilden är A till exempel mer elektronegativ än B, så i A-B-bindningen ligger den högsta elektrontätheten runt A.
Å andra sidan "ger B" upp sitt elektronmoln och omges därför av ett elektronfattigt område. Denna skillnad i elektronegativiteter mellan A och B skapar polaritetsgradienten.
Eftersom en region är rik på elektroner (δ-) medan den andra är fattig på elektroner (δ +), uppträder de två polerna, som, beroende på avstånden mellan dem, har olika storlekar på µ, som bestäms för varje förening.
Symmetri
Om en molekyl av en viss förening har µ = 0, sägs det vara en apolär molekyl (även om den har polaritetsgradienter).
För att förstå hur symmetri - och därmed molekylär geometri - spelar en viktig roll i denna parameter är det nödvändigt att överväga A-B-bindningen igen..
På grund av skillnaden i deras elektronegativiteter finns det definierade regioner som är rika och fattiga i elektroner.
Vad händer om länkarna var A-A eller B-B? I dessa molekyler skulle det inte finnas något dipolmoment, eftersom båda atomerna lockar mot dem på samma sätt elektronerna i bindningen (hundra procent kovalent bindning).
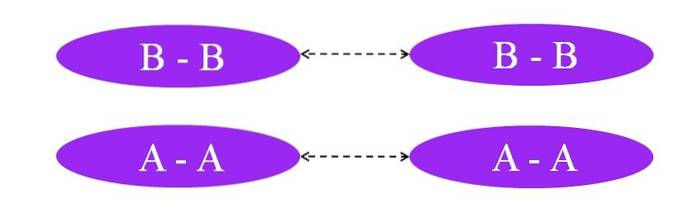
Som framgår av bilden finns varken i molekyl A-A eller i molekyl BB nu regioner som är rika eller fattiga i elektroner (rött och blått). Här är en annan typ av kraft ansvarig för att hålla ihop Atvå och Btvå: inducerade dipol-dipolinteraktioner, även kända som Londons styrkor eller spridningskrafter.
Tvärtom, om molekylerna var av AOA- eller BOB-typ, skulle det finnas avstötningar mellan deras poler eftersom de har lika laddningar:
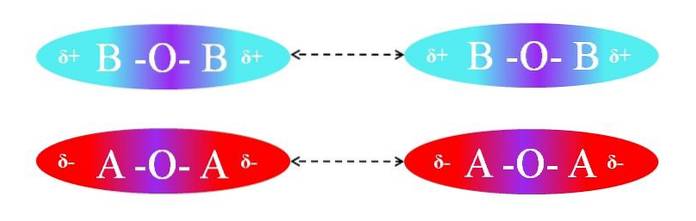
Δ + -regionerna i två BOB-molekyler tillåter inte effektiv dipol-dipolinteraktion; detsamma gäller för δ- regionerna för de två AOA-molekylerna. På samma sätt har båda paren av molekyler µ = 0. O-A-polaritetsgradienten avbryts vektorellt med den för A-O-bindningen.
Följaktligen kommer dispersionskrafter också till spel i AOA- och BOB-paret på grund av frånvaron av en effektiv orientering av dipolerna.
Asymmetri i icke-linjära molekyler
Det enklaste fallet är CF-molekylens4 (eller skriv CX4). Här har C en tetrahedral molekylär geometri och elektronrika regioner är i topparna, specifikt på de elektronegativa atomerna av F.
Polaritetsgradienten C-F upphävs i någon av riktningarna för tetraedern, vilket gör att vektorsumman av alla dessa är lika med 0.
Även om tetraederns centrum är mycket positivt (δ +) och dess hörn är mycket negativt (δ-), kan denna molekyl inte bilda dipol-dipolinteraktioner med andra molekyler..
Orienteringar av dipolerna
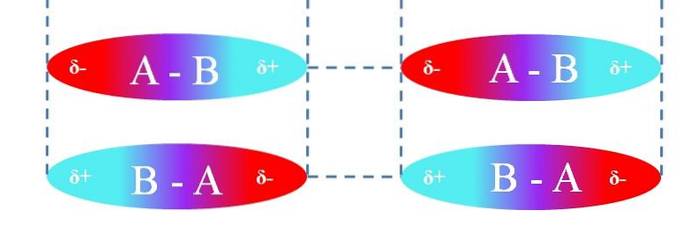
När det gäller linjära A-B-molekyler är de orienterade på ett sådant sätt att de bildar de mest effektiva dipol-dipol-interaktionerna (som framgår av bilden ovan). Ovanstående gäller på samma sätt för andra molekylära geometrier; till exempel de vinklade när det gäller NO-molekylertvå.
Således bestämmer dessa interaktioner huruvida förening A-B är en gas, en vätska eller ett fast ämne vid rumstemperatur..
När det gäller föreningar Atvå och Btvå (de av de lila ellipserna) är det mycket troligt att de är gasformiga. Men om dess atomer är mycket skrymmande och lätt polariserbara (vilket ökar Londons krafter), kan båda föreningarna vara antingen fasta eller flytande..
Ju starkare dipol-dipolinteraktioner är, desto större sammanhållning mellan molekylerna; på samma sätt desto högre smält- och kokpunkter för föreningen. Detta beror på att högre temperaturer behövs för att "bryta" dessa interaktioner..
Å andra sidan får en temperaturökning att molekylerna vibrerar, roterar och rör sig oftare. Denna "molekylära omröring" försämrar dipolernas riktningar och därför försvagas föreningens intermolekylära krafter..
Vätebindningsinteraktioner
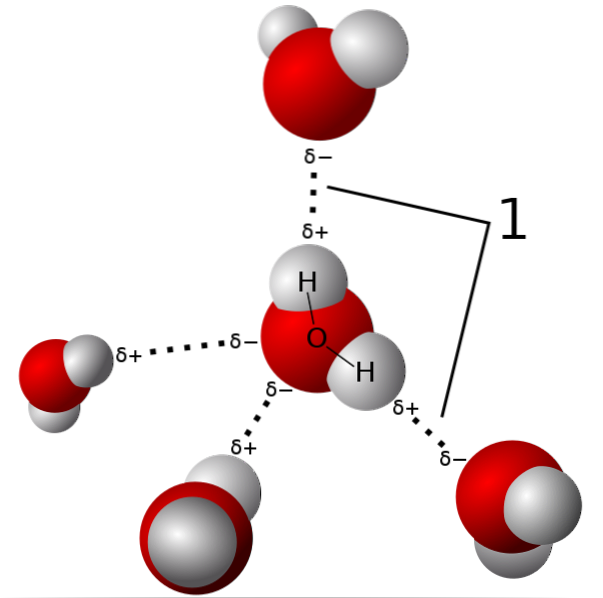
I bilden ovan visas fem vattenmolekyler som interagerar med vätebindningar. Detta är en speciell typ av interaktioner mellan dipol och dipol. Den elektronfattiga regionen ockuperas av H; och regionen rik på elektroner (δ-) är upptagen av de högelektronegativa atomerna N, O och F.
Det vill säga molekyler med N-, O- och F-atomer bundna till H kan bilda vätebindningar..
Således är vätebindningar O-H-O, N-H-N och F-H-F, O-H-N, N-H-O, etc. Dessa molekyler har permanenta och mycket intensiva dipolmoment, som orienterar dem korrekt för att "utnyttja" dessa broar..
De är energiskt svagare än någon kovalent eller jonbindning. Även om summan av alla vätebindningar i fasen av en förening (fast, flytande eller gasformig) får den uppvisa egenskaper som definierar den som unik..
Så är exempelvis fallet med vatten, vars vätebindningar är ansvariga för dess höga kokpunkt och för att de är mindre täta i istillståndet än flytande vatten; anledningen till att isberg flyter i havet.
Referenser
- Dipole-Dipole Forces. Hämtad den 30 maj 2018 från: chem.purdue.edu
- Gränslös inlärning. Dipole-Dipole Force. Hämtad den 30 maj 2018 från: courses.lumenlearning.com
- Jennifer Roushar. (2016). Dipole-Dipole Forces. Hämtad den 30 maj 2018 från: sophia.org
- Helmenstine, Anne Marie, Ph.D. (03 maj 2018). Vad är exempel på vätebindning? Hämtad den 30 maj 2018 från: thoughtco.com
- Mathews, C. K., Van Holde, K.E. och Ahern, K.G. (2002) Biokemi. Tredje upplagan. Addison Wesley Longman, Inc., P 33.
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan). CENGAGE Learning, s 450-452.
- Användare Qwerter. (16 april 2011). 3D-modell vätebindningar i toaletten. [Figur]. Hämtad den 30 maj 2018 från: commons.wikimedia.org


Ingen har kommenterat den här artikeln än.