
Kiselhistoria, egenskaper, struktur, erhållning, användningsområden
De kisel Det är ett icke-metalliskt och samtidigt metalloidt element som representeras av den kemiska symbolen Si. Det är en halvledare som är en väsentlig del av datorer, miniräknare, mobiltelefoner, solceller, dioder osv. Det är praktiskt taget huvudkomponenten som har möjliggjort upprättandet av den digitala tidsåldern.
Kisel har alltid funnits i kvarts och silikater, båda mineralerna utgör cirka 28 viktprocent av hela jordskorpan. Det är således det näst vanligaste elementet på jordens yta, och vidsträckta öknar och stränder erbjuder ett perspektiv på hur rikligt det är..

Kisel tillhör grupp 14 i det periodiska systemet, samma som kol, som ligger under det. Det är därför detta element anses vara en tetravalent metalloid; Den har fyra valenselektroner och i teorin kan den förlora dem alla för att bilda katjonen Si4+.
En fastighet som den delar med kol är dess förmåga att länka ihop; det vill säga deras atomer är kovalent bundna för att definiera molekylära kedjor. Likaså kan kisel bilda sina egna ”kolväten”, kallade silaner..
De dominerande kiselföreningarna i naturen är de berömda silikaterna. I sin rena form kan den framstå som ett monokristallint, polykristallint eller amorft fast ämne. Det är en relativt inert fast substans, så det utgör inte betydande risker.
Artikelindex
- 1 Historia
- 1.1 Kiselstenen
- 1.2 Isolering
- 1.3 Kristallint kisel
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Fysiskt utseende
- 2.2 Molmassa
- 2.3 Atomnummer (Z)
- 2.4 Smältpunkt
- 2.5 Kokpunkt
- 2.6 Densitet
- 2.7 Fusionsvärme
- 2.8 Förångningsvärme
- 2.9 Molär värmekapacitet
- 2.10 Elektronegativitet
- 2.11 Joniseringsenergier
- 2.12 Atomradie
- 2.13 Värmeledningsförmåga
- 2.14 Elektrisk resistivitet
- 2.15 Mohs hårdhet
- 2.16 Sammankoppling
- 2,17 oxidationsnummer
- 2.18 Reaktivitet
- 3 Struktur och elektronisk konfiguration
- 3.1 Kovalent karaktär
- 3.2 Elektrisk ledningsförmåga
- 3.3 Amorft kisel
- 4 Var att hitta och få
- 4.1 -Reduktion av kiseldioxid
- 5 isotoper
- 6 risker
- 7 användningsområden
- 7.1 Byggbranschen
- 7.2 Glas och keramik
- 7.3 Legeringar
- 7.4 Torkmedel
- 7.5 Elektronisk industri
- 7.6 Silikonpolymerer
- 8 Referenser
Berättelse
Kiselsten
Kisel är kanske ett av de element som har haft mest inflytande i mänsklighetens historia.
Detta element är huvudpersonen i stenåldern, och också i den digitala tidsåldern. Dess ursprung går tillbaka till att civilisationer en gång arbetade med kvarts och gjorde sina egna glasögon; och för närvarande är det huvudkomponenten i datorer, bärbara datorer och smartphones.
Kisel har praktiskt taget varit sten för två tydligt definierade epoker i vår historia.
Isolering
Eftersom kiseldioxid är så rikligt, ett namn som är född av flintsten, måste det innehålla ett extremt rikt element i jordskorpan; detta var rätt misstankar från Antoine Lavoisier, som 1787 misslyckades i sina försök att minska den från dess rost.
Någon tid senare, 1808, gjorde Humphry Davy sina egna försök och gav elementet sitt förnamn: "silicium", som översatt skulle bli "flintmetall". Det vill säga att kisel sedan ansågs vara en metall på grund av dess brist på karakterisering..
1811 lyckades de franska kemikerna Joseph L. Gay-Lussac och Louis Jacques Thénard för första gången bereda amorft kisel. För detta reagerade de kiseltetrafluoriden med metalliskt kalium. De renade eller karakteriserade emellertid inte den erhållna produkten, så de drog inte slutsatsen att det var det nya grundämnet silicium.
Det var först 1823 som den svenska kemisten Jacob Berzelius erhöll ett amorft kisel med tillräcklig renhet för att känna igen det som kisel; namnet gavs 1817 av den skotska kemisten Thomas Thomson när han betraktade det som ett icke-metalliskt element. Berzelius genomförde reaktionen mellan kaliumfluorsilikat och smält kalium för att producera detta kisel.
Kristallint kisel
Kristallint kisel bereddes först 1854 av den franska kemisten Henry Deville. För att uppnå detta utförde Deville en elektrolys av en blandning av aluminium och natriumklorider och fick sålunda kiselkristaller täckta av ett lager aluminiumsilicid, vilket han eliminerade (tydligen) genom att tvätta dem med vatten..
Fysiska och kemiska egenskaper
Fysiskt utseende

Kisel i sin rena eller elementära form består av ett gråaktigt eller blåsvart fast ämne (övre bild), som även om det inte är metall, har glänsande ansikten som om det verkligen var.
Det är ett hårt men sprött fast ämne, som också uppvisar en fjällig yta om den består av polykristaller. Amorft kisel ser däremot ut som ett mörkbrunt pulverformigt fast ämne. Tack vare detta är det lätt att identifiera och skilja en typ av kisel (kristallint eller polykristallint) från en annan (amorf).
Molmassa
28,085 g / mol
Atomnummer (Z)
14 (14Ja)
Smältpunkt
1414 ºC
Kokpunkt
3265 ºC
Densitet
-Vid rumstemperatur: 2,33 g / ml
-Precis vid smältpunkten: 2,57 g / ml
Observera att flytande kisel är tätare än fast kisel; vilket innebär att dess kristaller flyter i en flytande fas av samma, som det händer med isvattensystemet. Förklaringen beror på det faktum att det interatomära utrymmet mellan Si-atomerna i deras kristall är större (mindre tät) än motsvarande i vätskan (mer tät).
Fusionsvärme
50,21 kJ / mol
Förångningsvärme
383 kJ / mol
Molär värmekapacitet
19,789 J / (mol K)
Elektronnegativitet
1,90 på Pauling-skalan
Joniseringsenergier
-Först: 786,5 kJ / mol
-Andra: 1577,1 kJ / mol
-Tredje: 3231,6 kJ / mol
Atomradio
111 pm (uppmätt på deras respektive diamantkristaller)
Värmeledningsförmåga
149 W / (m K)
Elektrisk resistans
2.3 103 Ω · m vid 20 ºC
Mohs hårdhet
6.5
Sammankoppling
Kiselatomer har förmågan att bilda enkla Si-Si-bindningar, som slutligen definierar en kedja (Si-Si-Si ...).
Denna egenskap manifesteras också av kol och svavel; emellertid sp hybridiseringar3 kisel är mer bristfälliga jämfört med de andra två elementen och dessutom är deras 3p-orbitaler mer diffusa, så överlappningen av sp-orbitalerna3 resulterande är svagare.
Medelenergierna för de kovalenta bindningarna Si-Si och C-C är 226 kJ / mol respektive 356 kJ / mol. Därför är Si-Si-obligationerna svagare. På grund av detta är kisel inte livets hörnsten (och inte heller svavel). Faktum är att den längsta kedjan eller skelettet som kisel kan bilda är vanligtvis fyrledad (Si4).
Oxidationsnummer
Kisel kan ha något av följande oxidationsnummer, förutsatt att det i var och en av dem förekommer joner med sina respektive laddningar: -4 (Si4-), -3 (Ja3-), -2 (Jatvå-), -1 (Ja-), +1 (Ja+), +2 (Jatvå+), +3 (Ja3+) och +4 (Ja4+). Av dem alla är -4 och +4 de viktigaste.
Exempelvis antas -4 i silikider (MgtvåJa eller Mgtvåtvå+Ja4-); medan +4 motsvarar den för kiseldioxid (SiOtvå eller om4+ELLERtvåtvå-).
Reaktivitet
Kisel är helt olösligt i vatten, såväl som starka syror eller baser. Det löser sig emellertid i en koncentrerad blandning av salpetersyra och fluorvätesyror (HNO)3-HF). På samma sätt löser det sig i en het alkalisk lösning med följande kemiska reaktion:
Si (s) + 2NaOH (aq) + HtvåO (l) => NatvåJa3(aq) + 2Htvå(g)
Natriummetasilikatsaltet, NatvåJa3, Det bildas också när kisel löses upp i smält natriumkarbonat:
Si (s) + NatvåCO3(l) => NatvåJa3(l) + C (s)
Vid rumstemperatur reagerar den inte alls med syre, inte ens vid 900 ºC, när ett skyddsglasögon av SiO börjar bildastvå; och sedan, vid 1400 ºC, reagerar kislet med kvävet i luften för att bilda en blandning av nitrider, SiN och Si3N4.
Kisel reagerar också vid höga temperaturer med metaller för att bilda metallsilicider:
2Mg (s) + Si (s) => MgtvåJa
2Cu (s) + Si (s) => CutvåJa
Vid rumstemperatur reagerar den explosivt och direkt med halogener (det finns inget SiO-lagertvå för att skydda dig från detta). Till exempel har vi reaktionen av bildning av SiF4:
Ja (s) + 2Ftvå(g) => SiF4(g)
Och även om kisel är olösligt i vatten reagerar det glödhet med en ångström:
Ja (s) + HtvåO (g) => SiOtvå(s) + 2Htvå(g)
Struktur och elektronisk konfiguration
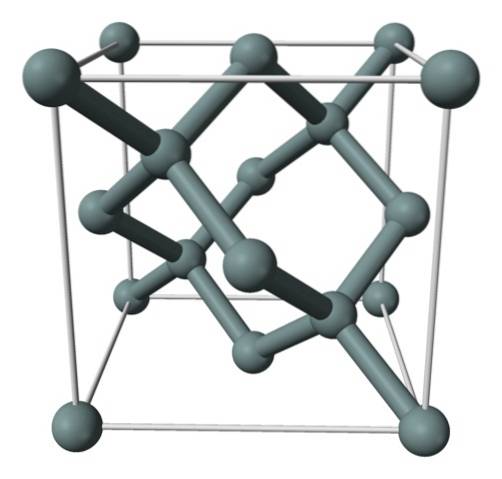
Bilden ovan visar den ansiktscentrerade kubiska strukturen (fcc), densamma som för diamant, för kiselkristall. De gråaktiga sfärerna motsvarar Si-atomerna, som, som man kan se, är kovalent kopplade till varandra; Dessutom har de tetraedriska miljöer som reproduceras längs kristallen.
Kiselkristallen är fcc eftersom en Si-atom observeras belägen på var och en av kubens ytor (6 × 1/2). På samma sätt finns det åtta Si-atomer vid kubens hörn (8 × 1/8) och fyra ligger inuti den (de som visar en väldefinierad tetraeder runt dem, 4 × 1).
Med detta sagt har varje enhetscell totalt åtta kiselatomer (3 + 1 + 4, siffror indikerade i stycket ovan); kännetecken som hjälper till att förklara dess höga hårdhet och styvhet, eftersom rent kisel är en kovalent kristallliknande diamant.
Kovalent karaktär
Denna kovalenta karaktär beror på att kisel, som kol, har fyra valenselektroner enligt sin elektroniska konfiguration:
[Ne] 3stvå 3ptvå
För limning är de rena 3s och 2p orbitalerna värdelösa. Det är därför som atomen skapar fyra hybrid-sp-orbitaler3, med vilken den kan bilda fyra Si-Si kovalenta bindningar och på detta sätt slutföra valensoktet för de två kiselatomerna.
Kiselkristallen visualiseras sedan som ett kovalent, tredimensionellt nätverk bestående av sammankopplad tetraeder..
Detta nätverk är dock inte perfekt, eftersom det har defekter och korngränser, som skiljer och definierar en kristall från en annan; och när sådana kristaller är mycket små och många talar vi om ett polykristallint fast ämne, identifierat av dess heterogena glans (liknar en silvermosaik eller fjällig yta).
Elektrisk ledningsförmåga
Si-Si-bindningarna, med sina väl placerade elektroner, håller i princip inte med vad som förväntas av en metall: ett hav av elektroner som "vätar" dess atomer; åtminstone är detta så vid rumstemperatur.
När temperaturen ökar börjar kislet emellertid leda elektricitet och beter sig därför som en metall; det vill säga det är ett halvledarmetalloidelement.
Amorft kisel
Kiseltetraeder antar inte alltid ett strukturellt mönster utan kan ordnas på ett oroligt sätt; och även med kiselatomer vars hybridiseringar inte verkar vara sp3 men sptvå, vilket bidrar till att ytterligare öka graden av störning. Därför talar vi om ett amorft och icke-kristallint kisel.
I amorft kisel finns elektroniska vakanser, där några av dess atomer har en omloppsbana med en oparad elektron. Tack vare detta kan dess fasta ämne hydreras, vilket ger upphov till bildning av hydrerat amorft kisel; det vill säga den har Si-H-bindningar, med vilka tetraedrarna fullbordas i oroliga och godtyckliga positioner.
Detta avsnitt avslutas sedan med att säga att kisel kan presenteras i tre typer av fasta ämnen (utan att nämna dess renhetsgrad): kristallint, polykristallint och amorft..
Var och en av dem har sin egen produktionsmetod eller process, liksom dess applikationer och avvägningar när man bestämmer vilken av de tre som ska användas, med vetskap om dess fördelar och nackdelar..
Var att hitta och få

Kisel är det sjunde mest förekommande elementet i universum och det andra i jordskorpan, vilket också berikar jordens mantel med sin stora familj av mineraler. Detta element associerar extremt bra med syre och bildar ett stort antal oxider; bland dem, kiseldioxid, SOtvå, och silikater (med olika kemisk sammansättning).
Kiseldioxid kan ses med blotta ögat i öknar och stränder, eftersom sand huvudsakligen består av SiOtvå. I sin tur kan denna oxid förekomma i några få polymorfer, den vanligaste var: kvarts, ametist, agat, kristobalit, tripoli, coesit, stishovite och tridymite. Dessutom kan den hittas i amorfa fasta ämnen såsom opaler och kiselgur..
Silikater är under tiden ännu rikare strukturellt och kemiskt. Några av silikatmineralerna inkluderar: asbest (vit, brun och blåaktig), fältspat, leror, micas, oliviner, aluminosilikater, zeoliter, amfiboler och pyroxener.
Praktiskt taget alla bergarter består av kisel och syre, med sina stabila Si-O-bindningar, och deras kiseldioxid och silikater blandade med metalloxider och oorganiska arter..
-Kiseldioxidreduktion
Problemet med att erhålla kisel bryter Si-O-bindningen, för vilken speciella ugnar och en bra reduktionsstrategi behövs. Råmaterialet för denna process är kiseldioxid i form av kvarts, som tidigare malts tills det är ett fint pulver..
Från denna malda kiseldioxid kan antingen amorft eller polykristallint kisel framställas..
Amorft kisel
I liten skala, utförd i ett laboratorium och med lämpliga åtgärder, blandas kiseldioxid med magnesiumpulver i en degel och förbränns i frånvaro av luft. Följande reaktion sker sedan:
Jatvå(s) + Mg (s) => 2MgO (s) + Si (s)
Magnesium och dess oxid avlägsnas med en utspädd saltsyralösning. Därefter behandlas det återstående fasta ämnet med fluorvätesyra så att SiO slutar reageratvå i överskott; i annat fall gynnar överskottet av magnesium bildningen av dess respektive silikid, MgtvåJa, oönskad förening för processen.
SiOtvå blir den flyktiga gasen SiF4, som utvinns för andra kemiska synteser. Slutligen torkas den amorfa kiselmassan under en ström av vätgas..
En annan liknande metod för att erhålla amorft kisel är att använda samma SiF4 tidigare producerad, eller SiCl4 (tidigare köpt). Ångorna från dessa kiselhalider föres över flytande natrium i en inert atmosfär, så att reduktionen av gasen kan ske utan närvaro av syre:
SiCl4(g) + 4Na (l) => Si (s) + 4NaCl (l)
Intressant är att amorf kisel används för att tillverka högeffektiva solpaneler.
Kristallint kisel
Med utgångspunkt från den pulveriserade kiseldioxiden eller kvartset förs de till en bågugn där de reagerar med koks. På detta sätt är reduktionsmedlet inte längre en metall utan ett kolhaltigt material med hög renhet:
Jatvå(s) + 2C (s) => Si (s) + 2CO (g)
Reaktionen ger också kiselkarbid, SiC, som neutraliseras med ett överskott av SiOtvå (återigen är kvarts i överskott):
2SiC (s) + SiOtvå(s) => 3Si (s) + 2CO (g)
En annan metod för att bereda kristallint kisel är att använda aluminium som reduktionsmedel:
3JAtvå(s) + 4Al (l) => 3Si (s) + 2AltvåELLER3(s)
Och med utgångspunkt från kaliumhexafluorurosilikatsaltet, Ktvå[SiF6] reageras den också med metalliskt aluminium eller kalium för att producera samma produkt:
Ktvå[SiF6] (l) + 4Al (l) => 3Si (s) + 6KF (l) + 4AlF3(g)
Kisel löses omedelbart i smält aluminium, och när systemet kyls kristalliseras det första och separeras från det andra; det vill säga kiselkristaller bildas som uppvisar grå färger.
Polykristallint kisel
Till skillnad från andra synteser eller produktioner, för att erhålla polykristallint kisel börjar man med en silangasfas, SiH4. Denna gas utsätts för en pyrolys över 500 ° C, på ett sådant sätt att en termisk sönderdelning inträffar och sålunda, från dess första ångor, slutar polykristaller av kisel på en halvledaryta.
Följande kemiska ekvation exemplifierar reaktionen som äger rum:
Ja H4(g) => Si (s) + Htvå(g)
Uppenbarligen borde det inte finnas något syre i kammaren, eftersom det skulle reagera med SiH4:
Ja H4(g) + 20två(g) => SiOtvå(s) + 2HtvåO (g)
Och sådan är spontaniteten i förbränningsreaktionen att den sker snabbt vid rumstemperatur med minimal exponering av silanen för luft..
En annan syntetisk väg för att producera denna typ av kisel börjar från kristallint kisel som råvara. De får det att reagera med väteklorid vid en temperatur runt 300 ºC, så att triklorsilan bildas:
Si (s) + 3HCl (g) => SiCl3H (g) + Htvå(g)
Och SiCl3H reagerar vid 1100 ° C för att regenerera kislet, men nu polykristallint:
4SiCl3H (g) => Si (s) + 3SiCl4(g) + 2Htvå(g)
Titta bara på ekvationerna för att få en uppfattning om arbetet och de stränga produktionsparametrar som måste beaktas..
Isotoper
Kisel förekommer naturligt och huvudsakligen som isotopen 28Ja, med ett överflöd på 92,23%.
Utöver detta finns det två andra isotoper som är stabila och därför inte genomgår radioaktivt sönderfall: 29Ja, med ett överflöd på 4,67%; Y 30Ja, med ett överflöd på 3,10%. Att vara så riklig 28Ja, det är inte förvånande att kiselens atomvikt är 28,084 u.
Kisel finns också i flera radioisotoper, bland vilka är 31Ja (t1/2= 2,62 timmar) och 32Ja (t1/2= 153 år). Övriga (22Ja - 44Om de har t1/2 väldigt kort eller kort (mindre än hundradels sekund).
Risker
Rent kisel är ett relativt inert ämne, så det ackumuleras vanligtvis inte i något organ eller vävnad så länge exponeringen för det är låg. I pulverform kan det irritera ögonen, orsaka sönderrivning eller rodnad, medan du vidrör det kan orsaka hudbesvär, klåda och skalning..
När exponeringen är mycket hög kan kisel skada lungorna. men utan efterverkningar, såvida inte mängden är tillräcklig för att orsaka kvävning. Detta är dock inte fallet med kvarts, som är förknippad med lungcancer och sjukdomar som bronkit och emfysem..
På samma sätt är rent kisel mycket sällsynt i naturen, och dess föreningar, så rikliga i jordskorpan, utgör ingen risk för miljön..
När det gäller organisk kisel kan dessa vara giftiga; Men eftersom det finns många av dem beror det på vilken man överväger, liksom andra faktorer (reaktivitet, pH, verkningsmekanism etc.).
Applikationer
Byggbranschen
Kiselmineraler utgör den "sten" som byggnader, hus eller monument byggs med. Till exempel består cement, betong, stuckaturer och eldfasta tegel av fasta blandningar baserade på silikater. Från detta tillvägagångssätt kan man föreställa sig nyttan av detta element i städer och i arkitektur..
Glas och keramik
Kristaller som används i optiska enheter kan tillverkas av kiseldioxid, oavsett om de är isolatorer, provceller, spektrofotometrar, piezoelektriska kristaller eller bara linser..
På samma sätt, när materialet bereds med flera tillsatser, slutar det att förvandlas till ett amorft fast ämne, välkänt som glas; och berg av sand är vanligtvis källan till den kiseldioxid eller kvarts som är nödvändig för dess produktion. Å andra sidan tillverkas keramiska material och porslin med silikater.
Sammanflätande idéer, kisel finns också i hantverk och prydnad.
Legeringar
Kiselatomer kan smälta samman och vara blandbara med en metallmatris, vilket gör den till en tillsats för många legeringar eller metaller. till exempel stål för att tillverka magnetiska kärnor; bronser för tillverkning av telefonkablar; och aluminium, vid produktion av aluminium-kisellegering avsedd för lätta bildelar.
Därför kan det inte bara hittas i byggnadens "sten" utan också i deras kolumner..
Torkmedel

Kiseldioxid, i gel eller amorf form, gör det möjligt att tillverka fasta ämnen som fungerar som torkmedel genom att fånga vattenmolekylerna som kommer in i behållaren och hålla dess inre torrt..
Elektronisk industri

Kiselskikt av olika tjocklekar och färger är en del av datorchips, eftersom deras fasta (kristallina eller amorfa) integrerade kretsar och solceller har utformats.
Som halvledare innehåller den atomer med mindre (Al, B, Ga) eller fler elektroner (P, As, Sb) för att omvandla den till halvledare av typen sid eller n, respektive. Med korsningarna av två silikoner, en n och den andra sid, ljusdioder tillverkas.
Silikonpolymerer
Det berömda silikonlimet består av en organisk polymer som stöds av stabiliteten hos kedjorna av Si-O-Si-bindningar ... Om dessa kedjor är mycket långa, korta eller tvärbundna, förändras egenskaperna hos silikonpolymeren, liksom deras slutliga ansökningar..
Bland dess användningar, listade nedan, kan följande nämnas:
-Lim eller lim, inte bara för att fästa papper utan byggstenar, gummi, glaspaneler, stenar etc..
-Smörjmedel i hydrauliska bromssystem
-Stärker färger och förbättrar färgernas ljusstyrka och intensitet, samtidigt som de kan klara temperaturförändringar utan att spricka eller äta bort.
-De används som vattenavvisande sprayer, som håller vissa ytor eller föremål torra
-De ger personlig hygienprodukter (tandkräm, schampo, gel, rakkrämer, etc.) känslan av att vara silkeslen
-Beläggningarna skyddar de elektroniska komponenterna i känsliga enheter, såsom mikroprocessorer, från värme och fukt
-Med silikonpolymerer har flera av gummikulorna tillverkats som studsar så fort de tappas på golvet..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Kisel. Återställd från: en.wikipedia.org
- MicroChemicals. (s.f.). Kristallografi av kisel. Återställd från: microchemicals.com
- Lenntech B.V. (2019). Periodiskt system: kisel. Återställd från: lenntech.com
- Marques Miguel. (s.f.). Uppträdande av kisel. Återställd från: nautilus.fis.uc.pt
- Mer Hemant. (5 november 2017). Kisel. Återställd från: hemantmore.org.in
- Pilgaard Michael. (22 augusti 2018). Kisel: Förekomst, isolering och syntes. Återställd från: pilgaardelements.com
- Dr. Doug Stewart. (2019). Fakta om kiselelement. Chemicool. Återställd från: chemicool.com
- Christiana Honsberg och Stuart Bowden. (2019). En samling resurser för solcellsutbildaren. PVutbildning. Återställd från: pveducation.org
- American Chemistry Council, Inc. (2019). Silikoner i vardagen. Återställd från: sehsc.americanchemistry.com



Ingen har kommenterat den här artikeln än.