
Esters egenskaper, struktur, användningsområden, exempel
De estrar De är organiska föreningar som har en karboxylsyra-komponent och en alkoholkomponent. Dess allmänna kemiska formel är RCOtvåR'' eller RCOOR''. Den högra sidan, RCOO, motsvarar karboxylgruppen, medan den högra sidan, OR'' det är alkohol. De två delar en syreatom och delar en del likhet med etrar (ROR ').
Av detta skäl etylacetat, CH3COOCHtvåCH3, den enklaste av estrarna ansågs den vara ättiksyra eller vinägereter, och därav det etymologiska ursprunget till namnet "ester". Så en ester består av substitution av det sura väte i COOH-gruppen, med en alkylgrupp från en alkohol.

Var finns estrar? Från jord till organisk kemi, dess naturliga källor är många. Den behagliga lukten av frukt, såsom bananer, päron och äpplen, är produkten av esters interaktion med många andra komponenter. De finns också i form av triglycerider i oljor eller fetter.
Vår kropp tillverkar triglycerider från fettsyror, som har långa kolkedjor, och glycerolalkohol. Vad som skiljer vissa estrar från andra finns i både R, kedjan för syrakomponenten och R ', för den alkoholhaltiga komponenten..
En ester med låg molekylvikt måste ha få kolatomer i R och R ', medan andra, såsom vax, har många kol speciellt i R', den alkoholhaltiga komponenten, och därför höga molekylvikter..
Men inte alla estrar är strikt organiska. Om kolatomen i karbonylgruppen ersätts med en av fosfor kommer vi att ha RPOOR '. Detta är känt som en fosfatester och de är av avgörande betydelse för DNA-strukturen..
Så länge en atom effektivt kan binda till kol eller syre, såsom svavel (RSOOR '), kan den följaktligen bilda en oorganisk ester.
Artikelindex
- 1 Fastigheter
- 1.1 Löslighet i vatten
- 1.2 Hydrolysreaktion
- 1.3 Reduktionsreaktion
- 1.4 Transförestringsreaktion
- 2 Struktur
- 2.1 Vätebindningsacceptor
- 3 Nomenklatur
- 4 Hur bildas de??
- 4.1 Förestring
- 4.2 Estrar från acylklorider
- 5 användningsområden
- 6 Exempel
- 7 Referenser
Egenskaper
Estrar är varken syror eller alkoholer, så de beter sig inte som sådana. Deras smält- och kokpunkter är till exempel lägre än de med liknande molekylvikter, men närmare värdena för aldehyder och ketoner..
Butansyra, CH3CHtvåCHtvåCOOH, har en kokpunkt på 164 ° C, medan etylacetat, CH3COOCHtvåCH3, av 77,1 ° C.
Bortsett från det senaste exemplet, kokpunkterna för 2-metylbutan, CH3CH (CH3) CHtvåCH3, av metylacetat, CH3COOCH3, och 2-butanol, CH3,CH (OH) CHtvåCH3, de är som följer: 28, 57 och 99 ° C. Alla tre föreningarna har molekylvikter 72 och 74 g / mol..
Estrar med låg molekylvikt tenderar att vara flyktiga och ha behaglig lukt, varför deras innehåll i frukt ger dem sina välbekanta dofter. Å andra sidan, när deras molekylvikter är höga, är de färglösa och luktfria kristallina fasta ämnen, eller beroende på deras struktur uppvisar de fettiga egenskaper..
Vattenlöslighet
Karboxylsyror och alkoholer är vanligtvis lösliga i vatten, såvida de inte har en hög hydrofob karaktär i sina molekylära strukturer. Detsamma gäller estrar. När R eller R 'är korta kedjor kan estern interagera med vattenmolekyler genom dipol-dipolkrafter och London-krafter..
Detta beror på att estrar är vätebindningsacceptorer. Hur? Med sina två syreatomer RCOOR '. Vattenmolekyler bildar vätebindningar med någon av dessa oxygener. Men när R- eller R-kedjorna är mycket långa, stöter de bort vattnet i sin miljö, vilket gör det omöjligt att lösa sig..
Ett uppenbart exempel på detta inträffar med triglyceridestrar. Sidokedjorna är långa och gör oljor och fetter olösliga i vatten, såvida de inte är i kontakt med ett mindre polärt lösningsmedel, mer besläktat med dessa kedjor..
Hydrolysreaktion
Estrar kan också reagera med vattenmolekyler i vad som kallas hydrolysreaktion. De kräver emellertid ett tillräckligt surt eller basiskt medium för att främja mekanismen för reaktionen:
RCOOR ' + HtvåELLER <=> RCOÅh + R'OH
(Syrmedium)
Vattenmolekylen lägger till karbonylgruppen, C = O. Syrahydrolys sammanfattas i substitutionen av varje R 'av den alkoholhaltiga komponenten med en OH från vatten. Observera också hur estern "bryts" i dess två komponenter: karboxylsyran, RCOOH och alkoholen R'OH..
RCOOR ' + Åh- => RCOELLER- + R'OH
(Grundmedium)
När hydrolys utförs i ett basiskt medium inträffar en irreversibel reaktion känd som förtvålning. Detta används ofta och är hörnstenen i produktionen av hantverks- eller industritvålar..
RCOO- är den stabila karboxylatanjonen, som associeras elektrostatiskt med den dominerande katjonen i mediet.
Om basen som används är NaOH bildas RCOONa-saltet. När estern är en triglycerid, som per definition har tre R-sidokedjor, bildas tre fettsyrasalter, RCOONa och alkoholglycerolen.
Reduktionsreaktion
Estrar är starkt oxiderade föreningar. Vad betyder det? Det betyder att den har flera kovalenta bindningar med syre. Genom att eliminera C-O-bindningarna uppstår ett brott som slutar separera de sura och alkoholhaltiga komponenterna; Vidare reduceras syran till en mindre oxiderad form, till en alkohol:
RCOOR '=> RCHtvåOH + R'OH
Detta är reduktionsreaktionen. Ett starkt reduktionsmedel behövs, såsom litiumaluminiumhydrid, LiAlH4, och från ett surt medium som främjar migrering av elektroner. Alkoholer är de minsta formerna, det vill säga de som har minst kovalenta bindningar med syre (endast en: C-OH).
De två alkoholerna, RCHtvåOH + R'OH, kommer från de två respektive kedjorna i den ursprungliga RCOOR'-estern. Detta är en metod för syntes av förädlade alkoholer från deras estrar. Om du till exempel vill göra en alkohol från en exotisk källa till estrar, skulle det vara en bra väg för det ändamålet..
Transförestringsreaktion
Estrar kan omvandlas till andra om de reagerar i sura eller basiska miljöer med alkoholer:
RCOOR ' + R "OH <=> RCOELLER " + R'OH
Strukturera
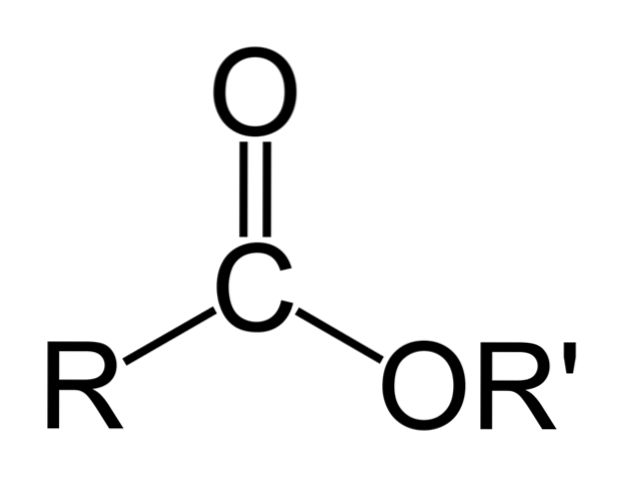
Den översta bilden representerar den allmänna strukturen för alla organiska estrar. Observera att R, karbonylgruppen C = O och OR ', bildar en platt triangel, produkt av sp-hybridiseringtvå av den centrala kolatomen. De andra atomerna kan emellertid anta andra geometrier, och deras strukturer beror på den inneboende naturen hos R eller R '.
Om R eller R 'är enkla alkylkedjor, till exempel av typen (CHtvå)nCH3, dessa kommer att visas sicksackade i rymden. Detta är fallet med Pentyl Butanoate, CH3CHtvåCHtvåCOOCHtvåCHtvåCHtvåCHtvåCH3.
Men i något av kolen i dessa kedjor kunde man hitta en förgrening eller omättnad (C = C, C2C), vilket skulle modifiera esternens globala struktur. Och av denna anledning varierar dess fysikaliska egenskaper, såsom löslighet och dess kok- och smältpunkter, för varje förening..
Omättade fetter har till exempel dubbelbindningar i sina R-kedjor, vilket påverkar intermolekylära interaktioner negativt. Som ett resultat sjunker deras smältpunkter tills de är flytande eller oljor vid rumstemperatur..
Vätebindningsacceptor
Även om esterskelettets triangel sticker ut mer i bilden är det R- och R-kedjorna som är ansvariga för mångfalden i deras strukturer..
Triangeln förtjänar dock en strukturell egenskap hos estrar: de är vätebindningsacceptorer. Hur? Genom syret i karbonyl- och alkoxidgrupperna (-OR ').
Dessa har par fria elektroner som kan locka delvis positivt laddade väteatomer från vattenmolekyler..
Därför är det en speciell typ av dipol-dipolinteraktioner. Vattenmolekylerna närmar sig estern (om de inte förhindras av R- eller R'-kedjorna) och C = O-H-broarna bildastvåO eller OHtvå-O-R '.
Nomenklatur
Hur heter estrar? För att korrekt namnge en ester är det nödvändigt att ta hänsyn till kolantalet i R- och R'-kedjorna. Likaså alla möjliga förgreningar, substituenter eller omättningar.
När detta väl är gjort läggs till suffixet -yl till namnet på varje R 'i alkoxidgruppen -OR' medan till kedjan R i karboxylgruppen -COOR är suffixet -ate. Avsnitt R nämns först, följt av ordet 'av' och sedan namnet på avsnitt R '.
Till exempel CH3CHtvåCHtvåCOOCHtvåCHtvåCHtvåCHtvåCH3 Den har fem kol på höger sida, det vill säga de motsvarar R '. Och på vänster sida finns fyra kolatomer (inklusive karbonylgruppen C = O). Därför är R 'en pentylgrupp och R en butan (för att inkludera karbonylen och betrakta huvudkedjan).
Så för att namnge föreningen, lägg bara till motsvarande suffix och namnge dem i rätt ordning: butanbunden av pentilo.
Hur man heter följande förening: CH3CHtvåCOOC (CH3)3? Strängen -C (CH3)3 motsvarar tert-butylalkylsubstituenten. Eftersom vänster sida har tre kol, är det en "propan". Dess namn är då: propanbunden av tert-butilo.
Hur bildas de?
Förestring
Det finns många vägar att syntetisera ester, varav några till och med kan vara nya. Men de konvergerar alla på det faktum att triangeln i bilden av strukturen måste formas, det vill säga CO-O-bindningen. För detta måste du börja från en förening som tidigare har karbonylgruppen: såsom en karboxylsyra.
Och vad ska karboxylsyra binda till? Till en alkohol, annars skulle det inte ha den alkoholhaltiga komponenten som kännetecknar estrar. Emellertid kräver karboxylsyror värme och surhet för att låta reaktionsmekanismen fortsätta. Följande kemiska ekvation representerar ovan nämnda:
RCOOH + R'OH <=> RCOOR '+ HtvåELLER
(Syrmedium)
Detta är känt som förestring.
Exempelvis kan fettsyror förestras med metanol, CH3OH, för att ersätta dess sura H med metylgrupper, så denna reaktion kan också betraktas som metylering. Detta är ett viktigt steg vid bestämning av fettsyraprofilen för vissa oljor eller fetter..
Estrar från acylklorider
Ett annat sätt att syntetisera estrar är från acylklorider, RCOCl. I stället för att ersätta en OH-hydroxylgrupp är Cl-atomen substituerad:
RCOCl + R'OH => RCOOR '+ HCl
Och till skillnad från förestringen av en karboxylsyra frigörs inte vatten utan saltsyra.
Andra metoder finns inom den organiska kemiens värld, såsom Baeyer-Villiger-oxidationen, som använder peroxisyror (RCOOOH)..
Applikationer

Bland de viktigaste användningarna av estrar är:
-När du gör ljus eller avsmalnar, som det i bilden ovan. Mycket långa sidokedjestrar används för detta ändamål..
-Som konserveringsmedel för läkemedel eller livsmedel. Detta beror på verkan av parabener, som inte är mer än estrar av para-hydroxibensoesyra. Även om de bevarar produktens kvalitet finns det studier som ifrågasätter dess positiva effekt på kroppen.
-De används för tillverkning av konstgjorda dofter som imiterar lukten och smaken av många frukter eller blommor. Således finns estrar i godis, glass, parfymer, kosmetika, tvålar, schampon, bland andra kommersiella produkter som förtjänar attraktiva dofter eller smaker..
-Estrar kan också ha en positiv farmakologisk effekt. Av denna anledning har läkemedelsindustrin ägnat sig åt att syntetisera estrar som härrör från syror som finns i kroppen för att utvärdera eventuell förbättring av behandlingen av sjukdomar. Aspirin är ett av de enklaste exemplen på dessa estrar.
-Flytande estrar, såsom etylacetat, är lämpliga lösningsmedel för vissa typer av polymerer, såsom nitrocellulosa och ett stort antal hartser.
Exempel
Några ytterligare exempel på estrar är följande:
-Pentylbutanoat, CH3CHtvåCHtvåCOOCHtvåCHtvåCHtvåCHtvåCH3, som luktar aprikos och päron.
-Vinylacetat, CH3COOCHtvå= CHtvå, från vilken polyvinylacetatpolymer framställs.
-Isopentylpentanoat, CH3CHtvåCHtvåCHtvåCOOCHtvåCHtvåCH (CH3)två, som efterliknar smaken av äpplen.
-Etylpropanoat, CH3CHtvåCOOCHtvåCH3.
-Propylmetanoat, HCOOCHtvåCHtvåCH3.
Referenser
- T.W. Graham Solomons, Craigh B. Fryhle. Organisk kemi. (Tionde upplagan, s 797-802, 820) Wiley Plus.
- Carey, F. A. Organic Chemistry (2006) Sjätte upplagan. Mc Graw Hill Publishing House-
- Kemi LibreTexts. Esters nomenklatur. Återställd från: chem.libretexts.org
- Administration. (2015, 19 september). Esters: Dess kemiska natur, egenskaper och användningar. Hämtad från: pure-chemical.com
- Organisk kemi i vårt dagliga liv. (9 mars 2014). Vad använder estrar? Återställd från: gen2chemistassignment.weebly.com
- Quimicas.net (2018). Exempel på estrar. Återställd från: quimicas.net
- Paz María de Lourdes Cornejo Arteaga. Huvudapplikationer för Esters. Hämtad från: uaeh.edu.mx
- Jim Clark. (Januari 2016). Vi presenterar Esters. Hämtad från: chemguide.co.uk



Ingen har kommenterat den här artikeln än.