
Kaliumsulfat (K2SO4) struktur, egenskaper, användningsområden, syntes

De kaliumsulfat är ett vitt eller färglöst oorganiskt salt vars kemiska formel är KtvåSW4. Det var redan känt på 1300-talet och kallades på 1600-talet som salt duplicatum, eftersom det är en kombination av ett syrasalt och ett alkaliskt salt..
Kaliumsulfat finns i mineralform i arkanit, men dess presentation är vanligare i de så kallade Stassfurt-salterna. Dessa är samkristallisationer av kalium, magnesium, kalcium och natriumsulfater, observerbara i mineraler såsom leonit och polyhalit..

Kaliumsulfat är ett lågt giftigt salt och orsakar endast irritation vid kontakt med ögonen, luftvägarna eller mag-tarmkanalen. Det finns inga tecken på cancerframkallande eller mutagen verkan.
Kaliumsulfat används som gödningsmedel, särskilt i grödor som är känsliga för klorider; så är fallet med tobak och potatis. Föreningen ger kalium, ett av de tre viktigaste näringsämnena i växter, och svavel, som finns i deras proteiner..
Artikelindex
- 1 Struktur
- 1.1 Kristallina faser
- 1.2 Jon trassel
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Namn
- 2.2 Molmassa
- 2.3 Fysiskt utseende
- 2.4 Densitet
- 2.5 Smältpunkt
- 2.6 Kokpunkt
- 2.7 Löslighet i vatten
- 2.8 Löslighet i organiska lösningsmedel
- 2.9 Brytningsindex (nD)
- 2.10 Reaktivitet
- 3 Syntes
- 3.1 Första metoden
- 3.2 Andra metoden
- 3.3 Tredje metoden
- 3.4 Fjärde metoden
- 4 användningsområden
- 4.1 Gödselmedel
- 4.2 Industriell användning och som råvara
- 4.3 Medicin
- 4.4 Veterinärmedicin
- 4.5 Matsmak
- 4.6 Andra användningsområden
- 5 risker
- 6 Referenser
Strukturera
Kristallina faser
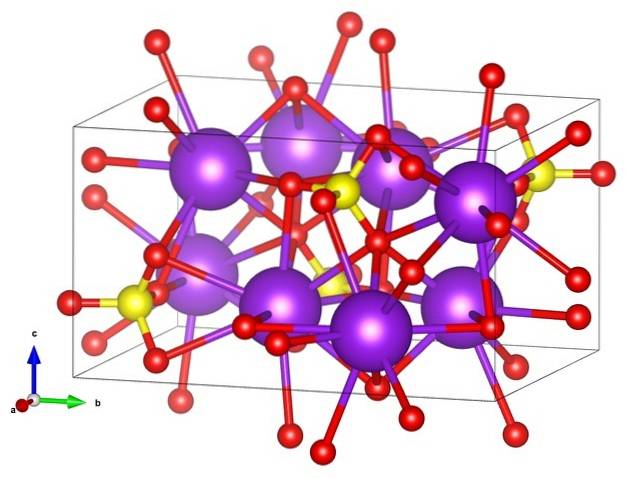
I den första bilden visades strukturformeln för kaliumsulfat. För varje SO-anjon4två-, av tetrahedral geometri, det finns två katjoner K+, som kan representeras av lila sfärer (övre bild).
Således ovan har vi den ortorombiska kristallstrukturen av KtvåSW4, med SO anjoner4två- representerad av gula och röda sfärer; medan K-katjoner+, redan sagt, de är de lila sfärerna (lite mer robusta).
Denna framställning kan orsaka förvirring om du tror att staplarna verkligen motsvarar koordinationslänkar. Snarare indikerar de vilken jon som interagerar direkt eller nära med en annan runt den. Det är därför varje syre "ansluter" med fem K+ (ELLER3SWtvå-- K+), och dessa i tur och ordning med tio oxygener från andra omgivande sulfatanjoner.
Det finns då en något "sällsynt" koordinationssfär för kalium i KtvåSW4:
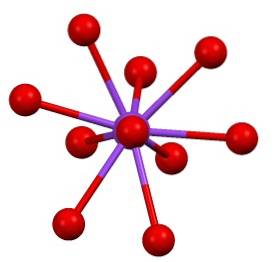
Denna kristallina struktur motsvarar polymorf β-KtvåSW4. Vid uppvärmning till 583 ºC sker en övergång till α-K-fasentvåSW4, vilket är sexkantigt.
Jontrassel
Visst K-strukturentvåSW4 det är ovanligt komplicerat för ett oorganiskt salt. Dess joner är placerade och bildar ett slags meningslöst trassel och, med blotta ögat, saknar periodicitet.
De som ägnar sig åt kristallografi kan närma sig detta trassel på ett mer lämpligt och beskrivande sätt och observera det från de tre rumsliga axlarna.
Observera att dess trassliga struktur kan förklara varför KtvåSW4 bildar inte hydrater: H-molekylertvåEller så har de inget sätt att tränga igenom kristallgitteret för att hydrera kaliumkatjoner.
Med så många interaktioner som ingår i jontrasseln kan det också förväntas att detta kristallgitter kommer att ha ganska stabil mot värme; och i själva verket är detta fallet, eftersom smältpunkten för KtvåSW4 är 1.069 ºC, vilket visar att dess joner är starkt sammanhängande.
Fysiska och kemiska egenskaper

Namn
-Kaliumsulfat
-Sulfat av kaliumklorid
-Arcanite
-Svavelpotash
Molmassa
174,259 g / mol
Fysiskt utseende
Vit, luktfri, bitter smakande kristallfast, granulat eller pulver.
Densitet
2,66 g / cm3
Smältpunkt
1.069 ºC
Kokpunkt
1 689 ºC
Vattenlöslighet
111 g / L vid 20 ºC
120 g / L vid 25 ºC
240 g / L vid 100 ºC
Lösligheten i vatten minskar på grund av närvaron av kaliumklorid, KCl eller ammoniumsulfat, (NH4)tvåSW4, på grund av den gemensamma joneffekten.
Löslighet i organiska lösningsmedel
Lätt löslig i glycerol, men olöslig i aceton och kolsulfid.
Brytningsindex (nD)
1 495
Reaktivitet
Kaliumsulfat kan reagera med svavelsyra och försuras för att bilda kaliumbisulfat (KHSO4). Det kan reduceras vid höga temperaturer till kaliumsulfid (KtvåS).
Syntes
Första metoden
Kaliumsulfat syntetiseras genom att reagera kaliumklorid med svavelsyra. Syntesen av kaliumsulfat sker i två steg. Det första steget innefattar bildandet av kaliumbisulfat.
Detta är en exoterm reaktion eftersom den släpper ut värme och därför inte kräver någon extern värmetillförsel. Reaktionen utförs vid rumstemperatur.
KCl + HtvåSW4 => HCl + KHSO4
Det andra steget i reaktionen är endotermiskt, det vill säga det kräver tillförsel av värme så att det kan inträffa.
KCl + KHSO4 => HCl + KtvåSW4
Andra metoden
Kaliumsulfat kan syntetiseras genom neutraliseringsreaktionen av svavelsyra med en bas, kaliumhydroxid:
HtvåSW4 + 2 KOH => KtvåSW4 + 2 timmartvåELLER
Tredje metoden
Kaliumsulfat produceras genom reaktion mellan svaveldioxid, syre, kaliumklorid och vatten.
Fjärde metoden
Kaliumsulfat produceras genom att extrahera kaliumsulfatet i en saltlösning från Loop Nur-bassängen, Kina. Kaliumsulfat separeras från de olösliga komponenterna i saltlösningen genom tillsats av den försurande föreningen natriumtripolyfosfat / ureafosfat.
Denna förening ökar skillnaden mellan kaliumsulfatets löslighet och de andra mindre lösliga föreningarnas löslighet, och uppnår enligt skaparna av metoden ett 100% rent kaliumsulfat. I strikt mening är det inte en syntesmetod, men det är en ny extraktionsmetod.
Applikationer
Gödselmedel

Användningen av kaliumsulfat som gödningsmedel är dess huvudsakliga tillämpning. 90% av dess totala produktion används för detta ändamål. Dess användning är att föredra framför kaliumklorid i de grödor som är känsliga för närvaron av klorid i jorden; till exempel tobak.
Kaliumsulfat har en kaliumhalt på 40-44%, medan dess svavelkoncentration representerar 17-18% av föreningen. Kalium är nödvändigt för att utföra många viktiga funktioner för växter, eftersom det aktiverar enzymatiska reaktioner, proteinsyntes, stärkelsebildning etc..
Dessutom är kalium involverat i att reglera vattenflödet i bladen. Svavel är nödvändigt för proteinsyntes, eftersom det finns i aminosyror som har det; sådant är fallet med metionin, cystein och cystin, och det ingriper också i enzymatiska reaktioner.
Även kaliumsulfat används genom sprutning på bladen i kaliumsulfatpartiklar mindre än 0,015 mm.
Industriell användning och som råvara
Rå kaliumsulfat används vid tillverkning av glas och vid tillverkning av alun och kaliumkarbonat. Det används som ett reagens vid tillverkning av kosmetika. Det används vid tillverkning av öl som vattenkorrigeringsmedel.
Medicin
Det används för att korrigera en allvarlig minskning av plasmakaliumkoncentrationen (hypokalemi), orsakad av överdriven användning av diuretika som ökar urinutsöndringen av kalium i urinen..
Kalium är den huvudsakliga intracellulära jonen i exciterande celler, inklusive hjärtceller. Därför äventyrar en allvarlig minskning av kalium i plasma hjärtfunktionen och måste korrigeras omedelbart..
Kaliumsulfat har en katartisk verkan, det vill säga det gynnar utvisning av avföring från tjocktarmen. Av denna anledning används en blandning av kalium-, magnesium- och natriumsulfater för att rensa kolon i avföringen innan en koloskopi utförs, vilket möjliggör en bättre visualisering av tjocktarmen av läkaren..
veterinär
Kaliumsulfat har använts för att minska metioninbehovet i fjäderfäfoder. Närvaron av 0,1% kaliumsulfat i foder hos värphöns är förknippat med en 5% ökning av äggproduktionen.
Matsmak
Det är ett smakämne som ger mat en bitter och salt smak som är önskvärd i vissa av dem. Dessutom noteras att kaliumsulfat har de fyra grundläggande smakerna: sötma, bitterhet, surhet och salthalt..
Salthalt, surhet och bitterhet ökar med koncentrationen av kaliumsulfat medan sötma minskar.
Andra användningsområden
Kaliumsulfat används som pyroteknik, i kombination med kaliumnitrat, för att generera en lila flamma. Används som en blixtreducering i artilleri-thruster-laddningar.
Dessutom används det som ett viskositetsökande medel i kosmetiska produkter som ansiktskrämer..
Risker
Kaliumsulfat är en låg giftig förening med mycket låg dödlighet. LD50 för den orala dosen hos möss är 6600 mg / kg djurvikt, vilket indikerar att en hög dos krävs för att orsaka musens död. Samma LD50-värde förekommer hos råttor.
I ögonen, vid kontakt, kan kaliumsulfat orsaka mekanisk irritation. På huden orsakar kaliumsulfat liten skada på industriell hantering..
Vid förtäring kan kaliumsulfat orsaka irritation i mag-tarmkanalen med illamående, kräkningar och diarré. Och slutligen orsakar inandning av kaliumsulfatdamm irritation i luftvägarna..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Kaliumsulfat. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Kaliumsulfat. PubChem-databas. CID = 24507. Återställd från: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (5 juli 2018). Kaliumsulfat. Royal Society of Chemistry. Återställd från: chemistryworld.com
- Marie T. Averbuch-Pouchot, A. Durif. (nitton nittiosex). Ämnen inom fosfatkemi. World Scientific. Återställd från: books.google.co.ve
- Kemikaliebok. (2017). Kaliumsulfat. Återställd från: chemicalbook.com
- Shoujiang L. et al. (2019). Rening och snabb upplösning av kaliumsulfat i vattenlösningar. DOI: 10.1039 / C8RA08284G
- DrugBank. (2019). Kaliumsulfat. Återställd från: drugbank.ca
- Mosaikföretaget. (2019). Kaliumsulfat. Crop Nutrition. Återställd från: cropnutrition.com
- Läkemedel. (2018). Natriumsulfat, kaliumsulfat och magnesiumsulfat (oral). Återställd från: drugs.com


Ingen har kommenterat den här artikeln än.