
Trietylaminstruktur, egenskaper, användningar och risker
De trietylamin är en organisk förening, närmare bestämt en alifatisk amin, vars kemiska formel är N (CHtvåCH3)3 eller NEt3. Liksom andra flytande aminer har den en lukt som liknar ammoniak blandad med fisk. dess ångor gör det tråkigt och farligt att hantera detta ämne utan en fläkt eller lämplig klädsel.
Förutom deras respektive formler förkortas denna förening ofta som TEA; detta kan emellertid leda till förvirring med andra aminer, såsom trietanolamin, N (EtOH)3, eller tetraetylammonium, en kvaternär amin, NEt4+.

Från dess skelett (toppbild) kan man säga att trietylamin är ganska lik ammoniak; medan den andra har tre väten, NH3, den första har tre etylgrupper, N (CHtvåCH3)3. Syntesen börjar från behandlingen av flytande ammoniak med etanol, en alkylering som sker.
Nätet3 kan bilda ett hygroskopiskt salt med HCl: trietylaminhydroklorid, NEt3· HCl. Utöver detta deltar det som en homogen katalysator i syntesen av estrar och amider, vilket gör det till ett nödvändigt lösningsmedel i organiska laboratorier..
Tillsammans med andra reagens tillåter det också oxidation av primära och sekundära alkoholer till aldehyder respektive ketoner. Som ammoniak är en bas och kan därför bilda organiska salter genom neutraliseringsreaktioner.
Artikelindex
- 1 Struktur av trietylamin
- 2 fastigheter
- 2.1 Fysiskt utseende
- 2.2 Molmassa
- 2.3 Kokpunkt
- 2.4 Smältpunkt
- 2.5 Densitet
- 2.6 Löslighet
- 2.7 Ångdensitet
- 2.8 Ångtryck
- 2.9 Henrys konstant
- 2.10 Flampunkt
- 2.11 Självantändningstemperatur
- 2.12 Värmekapacitet
- 2.13 Förbränningsvärme
- 2.14 Förångningsvärme
- 2.15 Ytspänning
- 2.16 Brytningsindex
- 2.17 Viskositet
- 2.18 Grundläggande konstant
- 2.19 Grundläggande
- 3 användningsområden
- 3.1 Polymerer
- 3.2 Kromatografi
- 3.3 Kommersiella produkter
- 4 risker
- 5 Referenser
Struktur av trietylamin
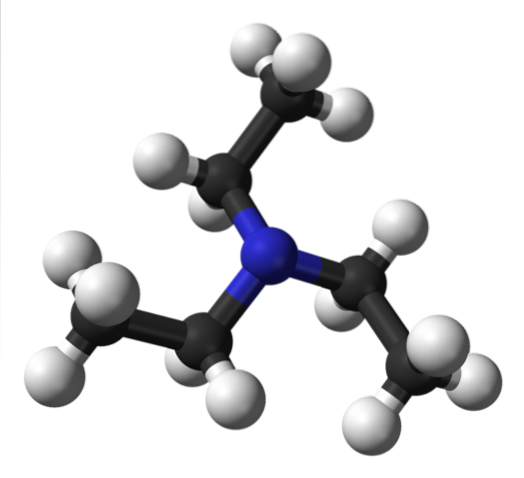
Den övre bilden visar strukturen av trietylamin med en modell av sfärer och stänger. I mitten av molekylen är kväveatomen, representerad av en blåaktig sfär; och kopplade till den, de tre etylgrupperna, som små grenar av svarta och vita kulor.
Även om de inte är synliga för blotta ögat, finns det på kväveatomen ett par odelade elektroner. Dessa två elektroner och de tre -CH gruppernatvåCH3 de upplever elektroniska avstötningar; men å andra sidan bidrar de till att definiera dipolmomentet för molekylen.
Emellertid är ett sådant dipolmoment mindre än för exempelvis dietylamin, NHEttvå; och på samma sätt saknar den någon möjlighet att bilda vätebindningar.
Detta beror på att det inte finns någon N-H-bindning i trietylamin och följaktligen observeras lägre smält- och kokpunkter jämfört med andra aminer som samverkar på ett sådant sätt..
Även om det finns ett litet dipolmoment kan dispersionskrafterna mellan etylgrupperna i NEt-molekyler inte uteslutas.3 grannar. Att lägga till denna effekt är det motiverat varför, även om trietylamin är flyktigt, kokar det vid cirka 89 ° C, tack vare sin relativt stora molekylvikt..
Egenskaper
Fysiskt utseende
Färglös vätska med obehaglig ammoniak och fisklukt.
Molmassa
101,193 g / mol.
Kokpunkt
89ºC.
Smältpunkt
-115 ° C Lägg märke till hur svaga de intermolekylära krafterna är som binder trietylaminmolekylerna i sitt fasta ämne.
Densitet
0,7255 g / ml.
Löslighet
Det är relativt lösligt i vatten, 5,5 g / 100 g vid 20 ° C. Enligt Pubchem är det under 18,7 ºC till och med blandbart med detta.
Förutom att "komma överens" med vatten är det också lösligt i aceton, bensen, etanol, eter och paraffin..
Ång-densitet
3,49 i luftförhållande.
Ångtryck
57,07 mmHg vid 25 ° C.
Henry är konstant
66 μmol / Pa Kg.
antändningspunkt
-15ºC.
Självantändningstemperatur
312ºC.
Värmekapacitet
216,43 kJ / mol.
Förbränningsvärme
10 248 cal / g.
Förångningsvärme
34,84 kJ / mol.
Ytspänning
20,22 N / m vid 25 ° C.
Brytningsindex
1400 vid 20 ° C.
Viskositet
0,347 mPa · s vid 25 ° C.
Grundläggande konstant
Trietylamin har en pKb lika med 3,25.
Grundläggande
Grunden för denna amin kan uttryckas med följande kemiska ekvation:
Netto3 + HA <=> NHEt3+ + TILL-
Där HA är en svag sur art. NHEt-paret3+TILL- utgör det tertiära ammoniumsaltet.
Konjugerad syra NHEt3+ är mer stabil än ammonium, NH4+, eftersom de tre etylgrupperna donerar en del av sin elektrontäthet för att minska den positiva laddningen på kväveatomen; därför är trietylamin mer basisk än ammoniak (men mindre basisk än OH-).
Applikationer

Grunden, i detta fall, används nukleofiliciteten för trietylamin för att katalysera syntesen av ester och amider från ett vanligt substrat: en acylklorid, RCOCl (övre bild).
Här attackerar det fria paret elektroner från kväve karbonylgruppen och bildar en mellanprodukt; som i följd attackeras av en alkohol eller en amin för att bilda en ester respektive amid.
I den första raden av bilden visualiseras mekanismen följt av reaktionen för att producera estern, medan den andra raden motsvarar amiden. Observera att trietylaminhydroklorid, NEt, produceras i båda reaktionerna3HCl, från vilken katalysatorn utvinns för att starta en ny cykel.
Polymerer
Nukleofiliciteten hos trietylamin används också för att lägga till vissa polymerer, härda dem och ge dem större massor. Till exempel är det en del av syntesen av polykarbonathartser, polyuretanskum och epoxihartser.
Kromatografi
Dess avlägsna amfifilicitet och flyktighet gör att dess härledda salter kan användas som reagens i jonbyteskromatografi. En annan implicit användning av trietylamin är att olika tertiära aminsalter kan erhållas från den, såsom trietylaminbikarbonat, NHEt3HCO3 (eller TEAB).
Kommersiella produkter
Det har använts som tillsatsmedel i formuleringen av cigaretter och tobak, konserveringsmedel för livsmedel, golvrengöringsmedel, smakämnen, bekämpningsmedel, färgämnen etc..
Risker
Trietylaminrök är inte bara obehagliga utan farliga, eftersom de kan irritera näsa, hals och lungor och leda till lungödem eller bronkit. Eftersom de är tätare och tyngre än luft, förblir de jämna med marken och flyttar till möjliga värmekällor för att senare explodera..
Behållare med denna vätska bör vara så långt borta från elden eftersom de utgör en överhängande explosionsrisk..
Dessutom bör dess kontakt med arter eller reagens såsom: alkalimetaller, triklorättiksyra, nitrater, salpetersyra (eftersom det skulle bilda nitrosoaminer, cancerframkallande föreningar), starka syror, peroxider och permanganater undvikas..
Det bör inte röra aluminium, koppar, zink eller deras legeringar, eftersom det har förmågan att korrodera dem.
När det gäller fysisk kontakt kan det orsaka allergier och hudutslag om exponeringen är akut. Förutom lungorna kan det påverka levern och njurarna. Och när det gäller ögonkontakt orsakar det irritation, vilket till och med kan skada ögonen om de inte behandlas eller rengörs i tid..
Referenser
- Morrison, R. T. och Boyd, R, N. (1987). Organisk kemi. 5: e upplagan. Ledare Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley plus.
- Wikipedia. (2019). Trietylamin. Återställd från: en.wikipedia.org
- Merck. (2019). Trietylamin. Återställd från: sigmaaldrich.com
- Nationellt centrum för bioteknikinformation. (2019). Trietylamin. PubChem-databas. CID = 8471. Återställd från: pubchem.ncbi.nlm.nih.gov
- Toxicology Data Network. (s.f.). Trietylamin. Återställd från: toxnet.nlm.nih.gov
- New Jersey Department of Health. (2010). Trietylamin. Återställd från: nj.gov


Ingen har kommenterat den här artikeln än.