
Specifik volym vatten, luft, ånga, kväve och idealgas
De specifik volym det är en intensiv egenskap som kännetecknar varje element eller material. Det definieras matematiskt som förhållandet mellan volymen upptagen av en viss mängd materia (ett kilogram eller ett gram); med andra ord, det är det ömsesidiga av densiteten.
Densiteten indikerar hur mycket 1 ml materia väger (flytande, fast, gasformig eller en homogen eller heterogen blandning), medan den specifika volymen avser volymen som upptar 1 g (eller 1 kg) av den. Att känna till ämnets densitet räcker sålunda att beräkna det ömsesidiga för att bestämma dess specifika volym.

Vad hänvisar ordet "specifikt" till? När någon egenskap sägs vara specifik betyder det att den uttrycks som en funktion av massa, vilket möjliggör dess omvandling från en omfattande egenskap (som beror på massa) till en intensiv (kontinuerlig vid alla punkter i systemet)..
Enheterna i vilka specifik volym normalt uttrycks är (m3/ Kg) eller (cm3/ g). Men även om den här egenskapen inte beror på massa beror den på andra variabler, såsom temperaturen eller trycket som inträffar på ämnet. Detta gör att ett gram ämne upptar mer volym vid högre temperaturer..
Artikelindex
- 1 Från vattnet
- 2 Från luften
- 3 Från ånga
- 4 Kväve
- 5 Av den ideala gasen
- 6 Referenser
Av vattnet
I den första bilden kan du se en droppe vatten som håller på att blanda sig med vätskans yta. Eftersom det naturligt är ett ämne upptar dess massa volym som alla andra. Denna makroskopiska volym är produkten av volymen och interaktioner mellan dess molekyler.
Vattenmolekylen har den kemiska formeln HtvåEller med en molekylvikt på cirka 18 g / mol. Densiteterna den beror också på temperatur, och i makroskala anses fördelningen av dess molekyler vara så homogen som möjligt..
Med densitetsvärdena ρ vid en temperatur T, för att beräkna den specifika volymen flytande vatten är det tillräckligt att tillämpa följande formel:
v = (1 / ρ)
Det beräknas genom att experimentellt bestämma vattnets densitet med hjälp av en pyknometer och sedan utföra den matematiska beräkningen. Eftersom molekylerna i varje substans skiljer sig från varandra kommer också den resulterande specifika volymen att göra.
Om vattentätheten över ett brett temperaturområde är 0,997 kg / m3, dess specifika volym är 1003 m3/ kg.
Från luften

Luft är en homogen gasblandning, som huvudsakligen består av kväve (78%), följt av syre (21%) och slutligen av andra gaser i jordens atmosfär. Dess densitet är ett makroskopiskt uttryck för all den blandningen av molekyler, som inte interagerar effektivt och sprids i alla riktningar..
Eftersom ämnet antas vara kontinuerligt ändrar inte spridningen i en behållare dess sammansättning. Återigen, genom att mäta densiteten vid de beskrivna temperatur- och tryckförhållandena, är det möjligt att bestämma vilken volym 1 g luft upptar.
Eftersom den specifika volymen är 1 / ρ och dess ρ är mindre än för vatten, är dess specifika volym större.
Förklaringen till detta faktum baseras på molekylära interaktioner mellan vatten och luft; det senare kondenserar inte, även om det är fukt, om det inte utsätts för mycket kalla temperaturer och höga tryck.
Från ånga
Kommer ett gram ånga att uppta en volym som är större än en gram luft under samma förhållanden? Luft är tätare än vatten i gasfasen, eftersom det är en blandning av gaser som nämns ovan, till skillnad från vattenmolekyler..
Eftersom specifik volym är den omvända densiteten upptar ett gram ånga mer volym (är mindre tät) än ett gram luft.
De fysiska egenskaperna hos ånga som vätska är väsentliga i många industriella processer: inuti värmeväxlare, för att öka luftfuktigheten, rengöra maskiner, bland andra..
Det finns många variabler att ta hänsyn till när man hanterar stora mängder ånga inom industrier, särskilt när det gäller fluidmekanik..
Kväve
Liksom resten av gaserna beror densiteten i hög grad på tryck (till skillnad från fasta ämnen och vätskor) och på temperaturen. Sålunda varierar värdena för dess specifika volym beroende på dessa variabler. Därav behovet av att bestämma dess specifika volym för att uttrycka systemet i termer av intensiva egenskaper.
Utan experimentella värden är det genom molekylärt resonemang svårt att jämföra kvävetätheten med den hos andra gaser. Kvävemolekylen är linjär (N≡N) och den för vatten är vinklad.
Eftersom en "linje" upptar mindre volym än en "Bumerang”, Sedan kan det förväntas att kväve enligt definitionen av densitet (m / V) är tätare än vatten. Med en densitet på 1 2506 kg / m3, den specifika volymen vid de förhållanden under vilka detta värde mättes är 0,7996 m3/ Kg; det är helt enkelt det ömsesidiga (1 / ρ).
Av den ideala gasen
Den ideala gasen är en som följer ekvationen:
P = nRT / V
Det kan ses att ekvationen inte tar hänsyn till någon variabel såsom molekylstruktur eller volym; det tar inte heller hänsyn till hur gasmolekyler interagerar med varandra i ett utrymme som definieras av systemet.
I ett begränsat temperatur- och tryckintervall "uppför sig" alla gaser samma; av detta skäl är det giltigt i viss utsträckning att anta att de följer den ideala gasekvationen. Från denna ekvation kan sålunda olika egenskaper hos gaser bestämmas, inklusive den specifika volymen.
För att lösa det är det nödvändigt att uttrycka ekvationen i termer av densitetsvariablerna: massa och volym. Molen representeras av n, och dessa är resultatet av att massan av gasen delas med dess molekylvikt (m / M).
Att ta den variabla massan m i ekvationen, om den divideras med volymen, kan densiteten erhållas; härifrån räcker det att rensa densiteten och sedan "vända" båda sidor av ekvationen. Genom att göra detta bestäms slutligen den specifika volymen.
Bilden nedan illustrerar vart och ett av stegen för att komma fram till det slutliga uttrycket för den specifika volymen av en idealgas.
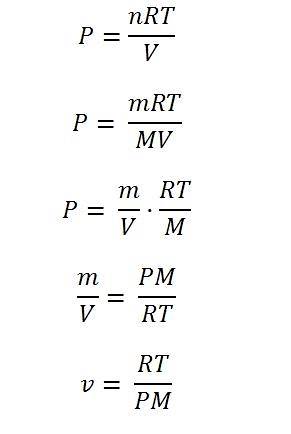
Referenser
- Wikipedia. (2018). Specifik volym. Hämtad från: en.wikipedia.org
- Study.com. (21 augusti 2017). Vad är specifik volym? - Definition, formel och enheter hämtad från: study.com
- POTT. (5 maj 2015). Specifik volym. Hämtad från: grc.nasa.gov
- Michael J. Moran & Howard N. Shapiro. (2004). Grundläggande för teknisk termodynamik. (2: a upplagan). Ledare Reverté, sidan 13.
- Enhet 1: Begrepp för termodynamik. [PDF]. Hämtad från: 4.tecnun.es
- TLV. (2018). Huvudapplikationer för Steam. Hämtad från: tlv.com

Ingen har kommenterat den här artikeln än.