
Svaveloxidformel, egenskaper, risker och användningar

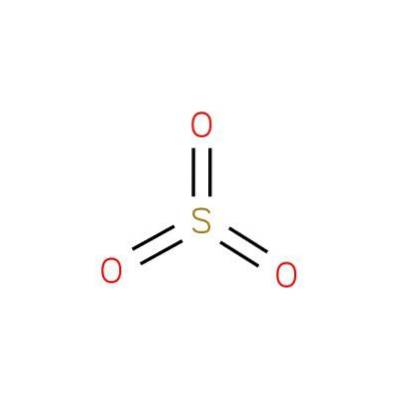
De svaveloxid (VI), även känd som svaveltrioxid eller svavelsyraanhydrid, är en kemisk förening med formeln SO3. Dess struktur presenteras i figur 1 (EMBL-EBI, 2016).
Svaveltrioxid produceras i utspädd gasform i en kontaktprocess svavelsyraanläggning genom oxidation av gaser som innehåller svaveldioxid..
Hittills är dock den enda beredningen av ren svaveltrioxid från gaser som innehåller SO3 utspädd, har varit en pilotanläggningsprocess som omfattar kryoskopisk kondens.
Det vanliga förfarandet innebär istället destillation av oleum. Värmen som erfordras för oleumdestillation tillföres bekvämt av varm kontaktgas från tillhörande svavelsyraanläggning..
Den kan beredas i laboratoriet genom att värma upp svavelsyra och samla sublimatet i en kyld mottagare. Om ångan kondenserar över 27 ° C erhålls gammaformen som en vätska.
Om ångan kondenserar under 27 ° C och i närvaro av ett fuktighetsspår erhålls en blandning av de tre formerna. De tre formerna kan separeras genom fraktionerad destillation.
Svaveloxidens fysikaliska och kemiska egenskaper
Svaveltrioxid är formad som vita nålar som förvandlas till rök i luften. Ofta stött på hämmare för att förhindra polymerisation (National Center for Biotechnology Information, 2017).
Dess molekylvikt är 80,066 g / mol, densiteten är 1,92 g / cm³ g / ml, och dess smält- och kokpunkter är 16,8 ° C respektive 44,7 ° C. (Royal Society of Chemistry, 2015).
Föreningen kombineras med vatten med explosiv kraft och bildar svavelsyra på grund av dess surhet. Svaveltrioxid karboniserar organiska ämnen.
Svaveltrioxid absorberar snabbt fukt och avger täta vita ångor. Lösningar av trioxiden i svavelsyra kallas rökande svavelsyra eller oleum. (Svaveltrioxid, 2016).
Reaktionen mellan svaveltrioxid och syrendifluorid är mycket kraftig och explosioner uppstår om reaktionen utförs i frånvaro av ett lösningsmedel. Reaktion av överskott av svaveltrioxid med tetrafluoroeten orsakar explosiv sönderdelning av karbonylfluorid och svaveldioxid..
Reaktionen mellan vattenfri perklorsyra och svaveltrioxid är våldsam och åtföljs av utvecklingen av betydande värme. Flytande svaveltrioxid reagerar våldsamt med nitrilklorid, även vid 75 ° C.
Reaktionen av svaveltrioxid och blyoxid orsakar vit luminiscens. Kombinationen av jod, pyridin, svaveltrioxid och formamid utvecklade en gas över trycksättning efter flera månader.
Detta beror på den långsamma bildningen av svavelsyra, yttre vatten eller uttorkning av formamid till vätecyanid (SULFUR TRIOXIDE, S.F.).
Reaktivitet och faror
Svaveltrioxid är en stabil förening, oförenlig med organiska material, finpulveriserade metaller, baser, vatten, cyanider och en mängd andra kemikalier..
Ämnet är en stark oxidant och reagerar våldsamt med brännbara och reducerande material och organiska föreningar som orsakar brand och explosionsrisk..
Reagerar våldsamt med vatten och fuktig luft för att producera svavelsyra. Lösningen i vatten är en stark syra, den reagerar våldsamt med baser och de är frätande metaller som bildar brandfarlig / explosiv gas.
Föreningen är frätande för metaller och tyger. Orsakar brännskador på ögon och hud. Förtäring orsakar svåra brännskador i munnen, matstrupen och magen. Ånga är mycket giftigt vid inandning. (National Institute for Occupational Safety and Health, 2015)
Vid kontakt med ögonen, kontrollera om du har kontaktlinser och ta bort dem omedelbart. Ögonen ska spolas med rinnande vatten i minst 15 minuter och håll ögonlocken öppna. Kallt vatten kan användas. Ögonsalva ska inte användas.
Om kemikalien kommer i kontakt med kläder ska du ta bort den så snabbt som möjligt och skydda dina egna händer och kropp. Placera offret under en säkerhetsdusch.
Om kemikalien ansamlas på utsatt hud, t.ex. händer, tvättas den förorenade huden försiktigt och försiktigt med rinnande vatten och icke-slipande tvål. Kallt vatten kan användas. Om irritation kvarstår, kontakta läkare. Tvätta de förorenade kläderna innan du använder dem igen.
Vid inandning ska offret tillåtas vila i ett väl ventilerat område. Om inandning är svår bör offret evakueras till ett säkert område så snart som möjligt. Lossa trånga kläder som en skjortkrage, bälte eller slips.
Om offret har svårt att andas bör syre ges. Om offret inte andas utförs återupplivning från mun till mun. Tänk alltid på att det kan vara farligt för personen som ger hjälp att ge återupplivning från mun till mun när det inandade materialet är giftigt, smittsamt eller frätande..
I samtliga fall bör omedelbar läkarvård sökas (säkerhetsdatablad svaveltrioxid, 2013).
Applikationer
Svaveltrioxid är ett viktigt reagens i sulfoneringsreaktioner. Dessa processer tillhandahåller rengöringsmedel, färgämnen och läkemedel. Framställs in situ från svavelsyra eller används som en rökande svavelsyralösning.
Luftföroreningar från svaveloxider är ett stort miljöproblem med miljontals ton svaveldioxid och trioxid som släpps ut i atmosfären varje år. Dessa föreningar är skadliga för växt- och djurliv, liksom för många byggmaterial.
Ett annat stort problem att tänka på är surt regn. Båda svaveloxiderna löses upp i vattendroppar i atmosfären för att bilda syralösningar som kan vara mycket skadliga när de fördelas i form av regn..
Svavelsyra antas vara den främsta orsaken till surhet från surt regn, vilket kan skada skogar och få fisk att dö i många sjöar.
Syrregn är också frätande för metaller, kalksten och andra material. Möjliga lösningar på detta problem är dyra på grund av svårigheten att ta bort svavel från kol och olja innan de brinner (Zumdahl, 2014).
Referenser
- EMBL-EBI. (2016, 2 december). svaveltrioxid. Hämtad från ChEBI: ebi.ac.uk
- Säkerhetsdatablad Svaveltrioxid. (2013, 21 maj). Hämtad från sciencelab: sciencelab.com
- Nationellt centrum för bioteknikinformation. (2017, 24 juni). PubChem Compound Database; CID = 24682 . Hämtad från PubChem: pubchem.ncbi.nlm.nih.gov
- National Institute for Occupational Safety and Health. (2015, 22 juli). SVÅLTRIOXID. Hämtad från cdc.gov: cdc.gov
- Royal Society of Chemistry. (2015). Svaveltrioxid. Hämtad från chemspider: chemspider.com
- Svaveltrioxid. (2016). Hämtad från chemicalbook: chemicalbook.com.
- SVÅLTRIOXID. (S.F.). Hämtad från CAMEO: cameochemicals.noaa.gov.
- Zumdahl, S. S. (2014, 13 februari). Hämtad från britannica: britannica.com.


Ingen har kommenterat den här artikeln än.